
- •1 Мета:
- •2 Матеріально-технічне та навчально-методичне забезпечення:
- •3 Теоретичні відомості:
- •4 Хід роботи:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 3
- •4 Хід роботи:
- •5 Висновки
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 4
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 5
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 6
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 7
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 8
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 9
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 10
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
4 Хід роботи:
4.1 Розчинність гліцерину у воді.
Змішайте у пробірці воду і гліцерин (приблизно по 1 мл). Додайте до суміші ще 1 мл гліцерину. Чи розчиниться він? Зробіть висновок про розчинність гліцерину у воді.
4.2 Взаємодія гліцерину з гідроксидом міді (ІІ).
У пробірку налийте 1 мл розчину гідроксиду натрію чи калію і додайте кілька крапель розчину сульфату купруму (ІІ). Що спостерігаєте? Додайте гліцерин, суміш збовтайте. Що спостерігаєте?
4.3 Прокалити мідну спіраль аж до появи чорної окалини та опустити в пробірку з етиловим спиртом . Що спостерігаємо?
4.4 В пробірку налити 1 мл етилового спирту і 1 мл концентрованої сульфатної кислоти. Пробірку закріпити в пробірко тримачі і обережно опустити в нагріту баню , додаючи по краплинам етиловий спирт з іншої пробірки. Дослід потрібно проводити дуже обережно, так як ефір з повітрям утворює вибухову суміш.
5 Висновки:
6 Контрольні питання:
6.1 Де використовують спирти?
6.2 Які сполуки називають гліцератами?
6.3 У яких напрямках може відбуватися реакція заміщення у спиртів? Наведіть приклади.
6.4 Трускавецька мінеральна вода «Юзя» містить гліцерин. Здавна місцеві дівчата вмиваються нею «для краси». На яких властивостях, на вашу думку, заснована дія цієї води?
Література
1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989.
2 Буринська Н.М., Величко Л.П. Хімія . Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
Інструкція для виконання лабораторної роботи № 6
Тема: Одержання і властивості альдегідів і кетонів.
1Мета:
1.1Єксперементально ознайомитися із властивостями альдегідів та кетонів.
1.2 Закріпити теоретичні знання на практиці.
2 Матеріально-технічне та навчально-методичне забезпечення:
2.1Пробірки
2.2 Водяна баня
2.3 Реактиви: 1% р-н нітрату срібла, 5% р-н аміаку, 10% р-н натрій гідроксиду, оцтовий альдегід, 2% р-н сульфату міді.
3 Теоретичні відомості:
Загальним способом добування альдегідів є окиснення спиртів. Ми вже розглядали таку реакцію. Для ілюстрації цього способу проведемо такий дослід. Розжаримо в полум'ї спиртівки спіраль з мідної дротини й опустимо її в пробірку із спиртом. Помічаємо, що спіраль, яка вкривається при нагріванні темним нальотом оксиду міді (II), у спирті знову стає блискучою; одночасно відчуємо запах альдегіду:

На практиці як окисник використовують кисень повітря і проводять реакцію за наявності металічного каталізатора — міді. Так, формальдегід добувають, пропускаючи через реактор із розжареною міддю суміш пари метилового спирту з повітрям. Мідь при цьому не витрачається, вона є переносником кисню повітря.
Освоєно також спосіб прямого окиснення етилену в оцтовий альдегід за наявності хлоридів паладію і міді:
![]()
Цей спосіб вважається найперспективнішим, бо в ваш, час етилен — доступніша і дешевша сировина для органічного синтезу, ніж ацетилен.
Хімічні властивості альдегідів:
1приєднання водню
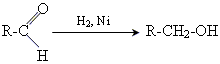
2 реакції окислення
окислення біхроматом калію
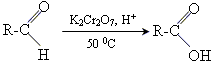
3 реакція срібного дзеркала

4 реакція окислення гідроксидом Купруму(ІІ)
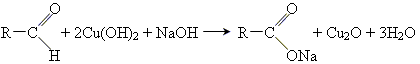
Кетонами називаються сполуки, в молекулах яких міститься група атомів >С = О, пов'язана з двома вуглеводневими радикалами.
Карбонільна група >С = О присутня в молекулах альдегідів, що зумовлює схожість хімічних властивостей альдегідів і кетонів. Проте схожість не є повною, оскільки в молекулах альдегідів один із зв'язків карбонільною групою витрачається на з'єднання з воднем, а в молекулах кетону обидва зв'язки йдуть на з'єднання з вуглеводневими радикалами. Це позначається, зокрема, на тому, що кетони окиснюються значно важче, ніж альдегіди, і не є такими енергійними відновниками, як альдегіди.
У практичному плані найважливішим з кетонів є диметилкетон, або ацетон -CH3COCH3.
Отримання і хімічні властивості кетонів
Отримання
1окислення вторинних спиртів
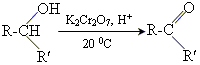
2 отримання за реакцією Кучерова

Хімічні властивості
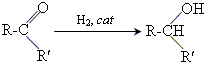
1 приєднання водню
2 реакції окислення для кетонів протікають лише під дією дуже сильних окислювачів і супроводжуються розривом вуглецевого ланцюга. кетони не дають реакцію срібного дзеркала і не окислюються гідроксидом Купруму(ІІ).
