
- •1 Мета:
- •2 Матеріально-технічне та навчально-методичне забезпечення:
- •3 Теоретичні відомості:
- •4 Хід роботи:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 3
- •4 Хід роботи:
- •5 Висновки
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 4
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 5
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 6
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 7
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 8
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 9
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 10
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
4 Хід роботи:
4.1 Одержання ацетилену. Ацетилен добувають у такому самому приладі, що й етилен. У пробірку поміщають 2-3 кусочки кальцій карбіду і закріплюють її в штативі вертикально. Наливають розчин сульфатної кислоти (1:3) об’ємом до 3 мл. Ацетилен, що при цьому виділяється, використовують для вивчення його хімічних властивостей. Записати рівняння реакції.
4.2 Взаємодія ацетилену з бромною водою. У пробірку вносять 1 мл бромної води і через неї пропускають ацетилен. Що спостерігають? Оскільки бром приєднується за місцем потрійного зв’язку ацетилену з утворенням тетраброметану. Реакція приєднання брому відбувається у дві стадії. Які продукти утворюються, записати рівняння реакцій.
4.3 Взаємодія ацетилену з водним розчинам калій перманганату. У пробірку вносять 1 мл 1%-ного розчину калій перманганату і через нього пропускають ацетилен. Що спостерігають? Під час окиснення ацетилену також розривається потрійний зв'язок.
4.4 Горіння ацетилену. Кінець газовідвідної трубки, з якої виділяється ацетилен, опускають у фарфорову чашку, наповнену мильною водою (1 г мила, 30-40 мл води). До мильних бульбашок, які при цьому утворюються, підносять запалену скалку. Спостерігають, як ацетилен горить кіптявим полум'ям, про що це свідчить?
5 Висновки:
6 Контрольні питання:
6.1 Напишіть рівняння реакції горіння ацетилену і розставте коефіцієнти. Обчислити масові частки карбону (у процентах) у та порівняйте їх.
6.2 Скільки літрів повітря потрібно для повного згоряння 1л метану, етилену і ацетилену ?
6.3 Чим відрізняються за складом ацетиленові вуглеводні?
6.4 Яка найхарактерніша хімічна властивість ненасичених вуглеводнів?
Література:
1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989.
2 Буринська Н.М., Величко Л.П. Хімія . Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
Інструкція для виконання лабораторної роботи № 5
Тема: Властивості спиртів.
1 Мета:
1.1Єксперементально ознайомитися із властивостями спиртів.
1.2 Закріпити теоретичні знання на практиці.
2 Матеріально-технічне та навчально-методичне забезпечення:
2.1Етиловий спирт.
2.2Пробірки.
2.3Спіраль із мідної дротини.
2.4Гліцерин, сульфат міді, р-н натрій гідроксид(10%), сульфатна кислота(концентрована).
2.5Пісчана баня
3 Теоретичні відомості:
Спирти — похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені гідроксильними групами (-OH). Гідроксильну групу зв'язану з sp3-гібридизованим атомом Карбону називають спиртовою. Органічні сполуки з двома гідроксильними групами називаються діолами, з трьома — триолами і т. д. В українській мові їх також називають багатоатомними спиртами.
Якщо до складу молекули спирту входить одна гідроксильна група, то такий спирт називають одноатомним, коли дві — двоатомним і т. д. Спирти, молекули яких містять дві і більше гідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню, то його називають насиченим, а коли від ненасиченого, то ненасиченим. В залежності від типу атома, до якого приєднана гідроксильна група спирти поділяють на первинні, вторинні та третинні.
Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю -CH2-. Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні їх назви утворюються з назв відповідних вуглеводів з додаванням закінчення ол. Наприклад, CH3—OH — метиловий спирт, або метанол; C2H5—OH — етиловий спирт, або етанол .
Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал. В таблиці наведений гомологічний ряд насичених одноатомних спиртів.
Нижчі спирти (з малою кількістю атомів Карбону в молекулі) при звичайній температурі є леткими рідинами, а вищі, починаючи з C15H31—OH, — тверді речовини. Нижчі спирти з водою зміщуються у всіх співвідношеннях. З підвищенням молекулярної маси розчинність спиртів зменшується. Усі спирти легші від води. В міру збільшення молекулярної маси температура кипіння спиртів підвищується.
Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з лужними металами і заміщувати гідроксильні атоми водню атомами металу з утворенням речовин, які називають алкоголятами. Наприклад:
2C2H5—OH + 2Na → 2C2H5—ONa + H2 ↑
У спиртах можуть заміщатися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється бромоетан:
![]()
Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище 160°С етилового спирту з надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен:
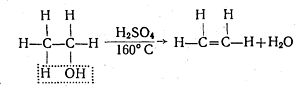
При слабшому нагріванні (близько 140 °С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
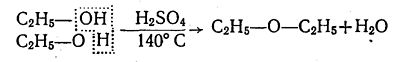
Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються складні ефіри. При цьому за рахунок гідроксильної групи кислоти і гідроксильного атома Гідрогену спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100 °C) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:
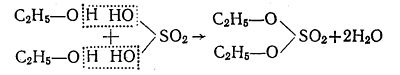
При повному окисненні спиртів утворюються вуглекислий газ та вода.
C2H5OH + O2 → CO2 + H2O
Гліцери́н (гліцеро́л) — трьохатомний спирт. Хімічна формула — C3H8O3, або C3H5(OH)3.
Молекулярна маса 92,09 г/моль. Температура кипіння 290 °C (розкладається). Температура плавлення 20 °C. Змішується з водою в будь-якій пропорції. Густина 1,261 г/см3 при 20 °C. Показник заломлення nD=1,4735 при 20 °C. Діелектрична проникність ε=42,5 при 25 °C. Дипольний момент молекули в газовому стані μ=2,56 Дб. В'язкість 9450 мПз[3]. Це безбарвна, в`язка, сиропоподібна, без запаху, солодка на смак, важча за воду і неотруйна рідина, що має здатність поглинати вологу з повітря та утримувати її.
Наявність гідроксильних груп зумовлює подібність гліцерину до одноатомних спиртів, він вступає в ті самі реакції, але за участю трьох гідроксильних груп.
Реакції повного окиснення (горіння) відбувається, як і в інших органічних речовин, з утворенням вуглекислого газу і води.
Гліцерин вступає в реакцію заміщення з металічним натрієм, яка супроводжується виділенням водню.
2С3Н5(ОН)3+6Na 2C3H5(ONa)3+3H2
Горіння:
2С3Н5(ОН)3+7О2 6CO2+8H2O
З нерозчинними основами:
C3H5(OH)3+Cu(OH)2 C3H5(OH)3Cu +H2O.
