
- •1 Мета:
- •2 Матеріально-технічне та навчально-методичне забезпечення:
- •3 Теоретичні відомості:
- •4 Хід роботи:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 3
- •4 Хід роботи:
- •5 Висновки
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 4
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 5
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 6
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 7
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 8
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 9
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 10
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
Міністерство освіти і науки, молоді та спорту України
Чернігівський промислово-економічний коледж
Київського національного університету технологій та дизайну
ЗАТВЕРДЖУЮ
Заступник директора з НР
__________С.В.Бондаренко
_____ ___________20__ р.
Методичні вказівки і завдання щодо виконання
лабораторних робіт з дисципліни
Органічна хімія
для студентів ІІ курсу
спеціальності 5.05130107 «Виготовлення виробів і покрить із полімерних матеріалів»
Уклав Дмитрук В.А.
Розглянуто на засіданні
циклової комісії хіміко-біологічних
дисциплін
Протокол №__ від __ __________ 20__ року
Голова циклової комісії (підпис)
Інструкція для виконання лабораторної роботи № 2
Тема: Добування метану із ацетату натрію і випробування його властивостей.
1 Мета:
1.1Ознацомитися з лабораторним методом одержання метану-представника насичених вуглеводнів.
1.2Вивчити властивості метану.
1.3Закріпити теоретичні знання на практиці.
2 Матеріально-технічне та навчально-методичне забезпечення:
2.1 Інструкція для виконання лабораторної роботи № 2
2.2Оццтовокислий натрій (безводний)
2.3Оксид кальцію.
2.4Марганцевокислий калій та бромна вода.
3 Теоретичні відомості:
Метан — безбарвний газ без запаху і смаку, майже у два рази легший від повітря. У воді малорозчинний.
Має густину за повітрям 0,555 (20 °C); молекулярна маса 16,04, tпл = −182,49 °C, tкип = −161,56 °C, критичний тиск 4,58 МПа, критична температура −82,°С, температура спалаху 87,8 °C, температура самозаймання 537,8 °C.
Перший член гомологічного ряду насичених (метанових) вуглеводнів. Метан являє собою малоактивну в хімічному відношенні речовину. При звичайних умовах він досить стійкий до дії кислот, лугів і окисників. Так, при пропусканні метану через розчин KMnO4, який є досить сильним окисником, він не окислюється і фіолетове забарвлення розчину не зникає. В реакції приєднання (сполучення) метан не вступає, оскільки в його молекулі всі чотири валентності атома вуглецю повністю насичені. Для метану, як і інших насичених вуглеводнів, типовими є реакції заміщення, при яких атоми водню заміщаються атомами інших елементів або атомними групами. Характерна для метану також реакція з хлором, яка відбувається при звичайній температурі під впливом розсіяного світла (при прямому сонячному світлі може статися вибух). При цьому атоми водню в молекулі метану послідовно заміщаються атомами хлору. Внаслідок реакції утворюється суміш хлорпохідних метану.
В атмосфері повітря метан горить безбарвним полум'ям з виділенням значної кількості тепла. З повітрям метан утворює вогненебезпечну вибухову суміш. При нагріванні метану без доступу повітря до температури вище 1000 °C він розкладається на елементи — на вуглець (сажу) і водень.
Метан є основним компонентом:
газів природних горючих (до 99,5 %),
нафтових попутних (39-91 %),
болотяних (понад 99 %) і рудникових (34-48 %) газів;
присутній у газах грязьових вулканів (понад 95 %),
спорадично зустрічається у вулканічних газах і в газах магматичних і метаморфічних порід.
4 Хід роботи:
4.1В суху пробірку насипати шаром в 2-3 мм суміші оцтовокислого натрію з натронним вапном (одна масова частина оцтовокислого натрію 2 частини натронного вапна). Пробірку закріпити горизонтально і приєднати газовідвідну трубку, як зображено на малюнку.
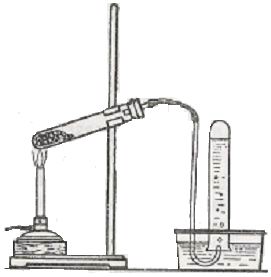
4.2 Метан , отриманий в ході реакції пропустити через розчини KMnO4 , Br2, чи спостерігаємо знебарвлення розчинів? По закінченню досліду піднести полум’я сірника до отвору трубки. Спостерігаємо горіння газу.
Записати відповідні рівняння реакцій.
Техніка безпеки: підпалювати метан після проходження його через розчини, а не одразу. Виконувати правила нагрівання, не тримати руками спиртівку.
6 Контрольні питання:
6.1 Завдяки якій властивості метану його можна спостерігати у вигляді бульбашок на поверхні заболочених водойм?
6.2 Який тип зв’язків між атомами в молекулі метану?
6.3 В які реакції вступає метан ? Напишіть рівняння, визначте типи реакцій.
6.4 Метан можна синтезувати з простих речовин. Складіть рівняння реакцій, чи має вона практичне значення?
6.5 Метан містить 5 % (за об’ємом) негорючих домішок. Який об’єм газу треба спалити, щоб отримати 2670 кДж теплоти?
Література:
1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989.
2 Буринська Н.М., Величко Л.П. Хімія . Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
