
- •1)Химическая стехиометрия. Постоянная Авогадро. Количество вещества. Моль. Эквивалент вещества. Эквивалентная масса. Закон эквивалентов. Расчёт эквивалентных масс кислот и оснований.
- •2)Расчет эквивалентов и эквивалентных масс различных классов неорганических соединений
- •3)Химическая термодинамика. Термодинамическая система. Типы термодинамических систем. Параметры, уравнения и функции состояния. Изобарные, изохорные, изотермические процессы.
- •4) Первое начало термодинамики. Расчет теплового эффекта для изобарного процесса. Энтальпия. Стандартная энтальпия.
- •5)Термохимия(тх). Термохимические уравнения(ту). Закон Лавуазье-Лапласа. Закон Гесса. Теплота сгорания топлива(тст).
- •7)Энтропия. Второе и третье начала тд. Зависимость энтропии от температуры. Оценка изменения энтропии в ходе реакций, протекающих с участием газообразных веществ.
- •8)Энергия Гиббса как критерий самопроизвольности протекания х.Р. Оценка влияния энтропийного и энергетического факторов на энергию Гиббса при высоких и низких температурах.
- •10)Зависимость скорости реакции от концентрации и парциального давления реагирующих веществ. Здм для простых и сложных реакций. Константа схр.
- •11)Зависимость V реакции от температуры. Правило Вант-Гоффа
- •12)Теория переходного состояния. Понятие о переходном состоянии. Координата реакции. Энергетические диаграммы для эндотермических и экзотермических реакций.
- •14)Химическое равновесие. Изменение концентрации реагирующих веществ и продуктов реакции с течением времени в обратимых реакциях.
- •15)Константа равновесия реакции и факторы, её определяющие Константа реакции, идущей с участием газообразных веществ. Связь константы равновесия с изменением энергии Гиббса х.Р.
- •16)Смещение химического равновесия(хр). Правило Ле-Шателье. Влияние температуры, давления и концентрации на хр.
- •17)Растворы. Растворитель и растворённое в-во. Различные способы выражения состава раствора. Молярная, эквивалентная и моляльная с. Массовая и молярная доля.
- •18)Растворимость веществ. Насыщенные растворы. Произведение растворимости(пр). Условие образования осадка малорастворимого соединения.
- •21) Электролитическая диссоциация. Равновесия в растворах электролитов. Степень диссоциации. Сильные и слабые электролиты.
- •22)Константа диссоциации. Факторы её определяющий. Закон разбавления Оствальда.
- •24) Гидролиз солей. Классификация солей по их отношению к гидролизу.
- •25) Сущность процесса гидролиза солей разного типа.
- •23) Фазовая диаграмма воды. Ионное произведение воды. Водородный и гидроксильный показатели. Способы измерения и расчета рН и рОн.
- •27)Электролитическая диссоциация комплексных соединений. Константа нестойкости.
- •28)Окислительно-восстановительные реакции. Электроотрицательность, степень окисления. Важнейшие окислители и восстановители.
- •29)Типы овр. Метод электронного баланса.
- •30)Электрохимия. Строение гальванического элемента Даниеля, катодные и анодные реакции, функция солевого мостика.
- •31)Стандартный электродный потенциал(сэп). Электрохимический ряд напряжений металлов.
- •32)Уравнение Нернста. Вывод уравнения Нернста для металлического и водородного электродов.
- •33) Основные типы гальванических элементов, применяемых в технике. Аккумуляторы. Топливные элементы.
- •34)Коррозия металлов. Классификация процессов коррозии по характеру поражения поверхности и по механизму.
- •35) Электрохимическая коррозия. Водородная и кислородная деполяризация,
- •37)Электролиз. Электролиз расплавов солей.
- •38)Особенность электролиза водных р-в. Участие воды в реакциях окисления и восстановления.
- •38)Последовательность катодных процессов при электролизе водных растворов неорганических соединений.
- •39) Последовательность разрядки ионов на электродах при электролизе. Электролиз с использованием различных видов электродов.
- •40)Законы электролиза(Фарадея). Выход по току. Применение электролиза.
- •41) Строение атома. Квантово-механическое описание атома. Понятие о волновой функции.
- •42) Строение многоэлектронных атомов. Принцип минимума энергии. Принцип Паули. Правило Хунда.
- •43)Атомные орбитали(ао). Квантовые числа: главное, орбитальное, магнитное, спиновое. Интерпретация квантовых чисел.
- •44)Периодические свойства. Потенциал ионизации. Сродство к е. Радиус атома
- •45)Химическая связь. Ковалентная (обменная и донорно-акцепторная), ионная и металлическая связь.
- •46)Метод молекулярных орбиталей(мо). Строение молекулы н с позиции теории (мо).
- •47)Основы зонной теории. Проводники, полупроводники и диэлектрики с позиции зонной теории. Понятие о примесной проводимости проводников.
- •48)Химия металлов. Свойства металлов. Классификация металлов и их распространенность в природе.
- •49… Металлургия. Типы восстановления металлов из руд.
- •50… Алюминий» титан. Свойства и применение
23) Фазовая диаграмма воды. Ионное произведение воды. Водородный и гидроксильный показатели. Способы измерения и расчета рН и рОн.
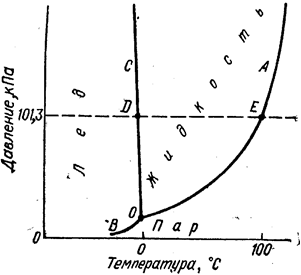
3 кривые разделяют диаграмму на области, каждая из которых отвечает 1му агрег. сост. Каждая область имеет 1 фазу(однофазно)
Концентрации ионов H+ и OH- равны, следовательно [H+] = [OH-] = 10-7 моль/л. Раствор с одинаковыми концентрациями ионов называется нейтральным. Если [H+] > [OH-] то раствор кислый, наоборот - [H+] < [ОН-] - щелочной или основный.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: рН = - lg[H+]
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила: рОН = - lg[OH-]
Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
27)Электролитическая диссоциация комплексных соединений. Константа нестойкости.
Диссоциация КС протекает в 2 ступени:
 ;
;
 - катион
- катион ;
;
 -
катион
-
катион
На 1-ой ступени в водных растворах происходит полная 100% диссоциация комплексных соединений по ионам. Данный ионный процесс не обратим. На 2-ой ступени диссоциирует комплексный ион по типу слабых электролитов т.е. данный процесс обратим.
 ;
;
![]() ,
,
![]() -константа
нестойкости компл. иона.
-константа
нестойкости компл. иона.
 ;
-это
мера стабильности комплексного иона в
водных растворах. Чем больше константа
нестойкости тем менее устойчив комплексный
ион.
;
-это
мера стабильности комплексного иона в
водных растворах. Чем больше константа
нестойкости тем менее устойчив комплексный
ион.
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса.
28)Окислительно-восстановительные реакции. Электроотрицательность, степень окисления. Важнейшие окислители и восстановители.
Окислительно-восстановительные реакции - это химические реакции, протекающие с изменением степени окисления одного или нескольких элементов входящих в состав реагирующих веществ.Окисление – процесс отдачи электронов. Восстановление- процесс присоединения электронов. Степень окисления- это заряд который приобрел бы атом если бы все электронные пары химических соединений сместились бы в сторону атомов более электроотрицательных элементов. Это безразмерная величина и может быть равна 0.
Важнейшие окислители:
О2,типичные металлы в виде простых в-в F2,I2,Br2,Cl2 элементы6,7 главной подгруппы,сложные в-ва содержащие элементы в высших степенях окисления,пироксиды металлов H2,O2,O3,кислородосодержащие кислоты содержащие элементы в высших С/О и их соли,вода (морская вода),некоторые оксиды металлов PbO2,ионы благородных металов
Важнейшие восстановители:
Н2, в виде простого в- ва, СО и СО2
все металлы в виде простых в-в
бескислородные кислоты и их соли
в случае когда в ходе реакции образуются простые в –ва
соединения содержащие элементы в низших степенях окисления
соли сернистой и азотистой кислот
гидриды щелочных металлов
