
- •13.Волновая функция частицы, волны и микрообъекта. Соотношения неопределенностей, их смысл
- •14.Фундаментальность неопределенности. Устойчивость атома с точки зрения принципа неопределенности.
- •15.Волновые свойства микрочастиц. Задание состояния микрочастиц. Волновая функция, ее смысл и свойства Корпускулярные и волновые свойства частиц. Принцип неопределенности
- •17 Простейшие квантовые модели – потенциальный порог, потенциальный барьер.
- •18. Туннельный эффект и его распространенность в природе. Химические реакции, автоэлектронная эмиссия. Механизм туннелирования с точки зрения принципа неопределенности.
- •23.Химическая связь.Межмолекулярное взаимодействие
- •30. Модель свободных электронов. Образование запрещенной зоны в сплошном энергетическом спектре свободных электронов под влиянием кристаллической решетки.
- •31. Уровень Ферми. Заполнение зон: металлы, диэлектрики и полупроводники.
- •32. Зонная структура различных материалов
- •33.Собственные и примесные полупроводники. P– и n-проводимость.
- •34. Понятие о p – n переходе. Вольтамперная характеристика.
- •35. Транзистор. Принцип работы, применения. Микроэлектроника, значение миниатюризации приборов.
- •37. Относительность пространства в теории относительности.
- •39 Динамика теории относительности. Масса и энергия
- •40 Стандартная модель элементарных частиц. Кварки, лептоны и кванты фундаментальных полей.
17 Простейшие квантовые модели – потенциальный порог, потенциальный барьер.
Потенциа́льный барье́р — область пространства, разделяющая две другие области с различными или одинаковыми потенциальными энергиями. Характеризуется «высотой» — минимальной энергией классической частицы, необходимой для преодоления барьера.
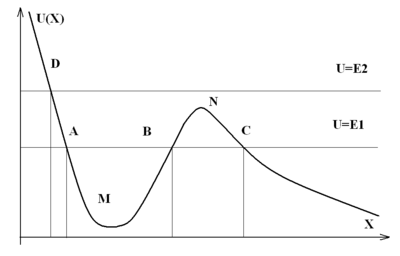
На приведённом изображении участок BNC является потенциальным барьером для частицы с энергией E1. Потенциальным барьером для частицы с энергией E2 служит участок от нуля до точки D, так как частица не в состоянии подойти к началу координат ближе, чем координата точки D.
В классической механике, в случае, когда частица не обладает энергией, большей максимума для данного барьера, она не сможет преодолеть потенциальный барьер. В квантовой механике, напротив, возможно преодоление барьера с определённой вероятностью (туннельный эффект).
18. Туннельный эффект и его распространенность в природе. Химические реакции, автоэлектронная эмиссия. Механизм туннелирования с точки зрения принципа неопределенности.
Тунне́льный эффект, туннели́рование — преодоление микрочастицей потенциального барьера в случае, когда её полная энергия (остающаяся при туннелировании неизменной) меньше высоты барьера. Туннельный эффект — явление исключительно квантовой природы, невозможное в классической механике и даже полностью противоречащее ей. Аналогом туннельного эффекта в волновой оптике может служить проникновение световой волны внутрь отражающей среды (на расстояния порядка длины световой волны) в условиях, когда, с точки зрения геометрической оптики, происходит полное внутреннее отражение. Явление туннелирования лежит в основе многих важных процессов в атомной и молекулярной физике, в физике атомного ядра, твёрдого тела и т. д.
Туннельный эффект можно объяснить соотношением неопределённостей.[1] Записанное в виде:
![]()
оно показывает, что при ограничении квантовой частицы по координате, то есть увеличении её определённости по x, её импульс p становится менее определённым. Случайным образом неопределённость импульса может добавить частице энергии для преодоления барьера. Таким образом, с некоторой вероятностью квантовая частица может проникнуть через барьер, а средняя энергия частицы останется неизменной.
Автоэлектронная эмиссия — это испускание электронов проводящими твердыми и жидкими телами под действием внешнего электрического поля без предварительного возбуждения этих электронов, то есть без дополнительных затрат энергии, что свойственно другим видам электронной эмиссии. Суть явления состоит в туннелировании электронов сквозь потенциальный барьер вблизи поверхности тела. Такое туннелирование становится возможным за счёт искривления потенциального барьера при приложении внешнего поля. При этом появляется область пространства вне тела, в которой электрон может существовать с той же энергией, которой он обладает, находясь в теле. Таким образом, автоэлектронная эмиссия обусловлена волновыми свойствами электронов.
Впервые такое объяснение автоэмиссии было предложено в 1928 г. Фаулером и Нордгеймом. Ими впервые была получена формула, описывающая взаимосвязь плотности автоэлектронного тока j с напряжённостью электрического поля E. Формула Фаулера — Нордгейма справедлива при токах автоэлектронной эмиссии j≤108 А/см2. При более высоких плотностях функция j(E) почти не зависит от работы выхода металла. Причина этого эффекта — появление объёмного заряда вблизи эмиттера. Ток автоэлектронной эмиссии в этом случае определяется законом степени трёх вторых.
Во время автоэлектронной эмиссии катод разогревается из-за разницы между средней энергией электронов подходящих к поверхности катода, и средней энергией электронов уходящих сквозь потенциальный барьер. Данное явление называют эффектом Ноттингема.
(Практическое применение :Автоэмиссионная (полевая) микроскопия и связанные с ней области
Автоэлектронная (полевая) спектроскопия (анализ энергии электронов)
Автоэлектронные (полевые) эмиттеры как источники электронной пушки
Эмиттеры с атомарным острием)
19 Частица в сферически симметричном поле. Водородоподобные атомы. Квантовые числа. Энергетические уровни. Потенциалы возбуждения и ионизации.. Частица в сферически симметричном поле. Водородоподобные атомы. Квантовые числа. Энергетические уровни. Потенциалы возбуждения и ионизации.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями,
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов).
 Магнитное
квантовое число m определяет ориентацию
орбитали в пространстве относительно
внешнего магнитного или электрического
поля. Его значения изменяются от +l до
-l, включая 0. Например, при l = 1 число m
принимает 3 значения: +1, 0, -1, поэтому
существуют 3 типа р-АО: рx, рy, рz.
Магнитное
квантовое число m определяет ориентацию
орбитали в пространстве относительно
внешнего магнитного или электрического
поля. Его значения изменяются от +l до
-l, включая 0. Например, при l = 1 число m
принимает 3 значения: +1, 0, -1, поэтому
существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: и .
К
главное квантовое
число
n
орбитальное
квантовое число
l
магнитное
квантовое число
ml
спиновое квантовое
число
ms
Энергетические уровни и подуровни
Совокупность состояний электрона в атоме с одним и тем же значением n называют энергетическим уровнем. Число уровней, на которых находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент. Номера этих уровней обозначают цифрами: 1, 2, 3,... (реже - буквами K, L, M, ...).
Энергетический подуровень - совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначают буквами: s, p, d, f... Первый энергетический уровень имеет один подуровень, второй - два подуровня, третий - три подуровня и так далее.
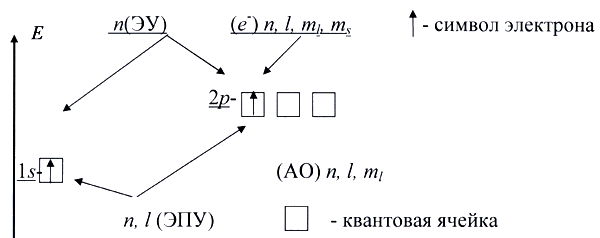
Если на схеме орбитали обозначить в виде ячеек (квадратных рамок), а электроны - в виде стрелок (↑ или ↓), то можно увидеть, что главное квантовые число характеризуют энергетический уровень (ЭУ), совокупность главного и орбитального квантовых чисел - энергетический подуровень (ЭПУ), совокупность главного, орбитального и магнитного квантовых чисел - атомную орбиталь, а все четыре квантовые числа - электрон.
Каждой орбитали отвечает определенная энергия. Обозначение орбитали включает номер энергетического уровня и букву, отвечающую соответствующему подуровню: 1s, 3p, 4d и т.п. Для каждого энергетического уровня, начиная со второго, возможно существование трех равных по энергии p-орбиталей, расположенных в трех взаимно перпендикулярных направлениях. На каждом энергетическом уровне, начиная с третьего, имеется пять d-орбиталей, имеющих более сложную четырехлепестковую форму. Начиная с четвертого энергетического уровня, появляются еще более сложные по форме f-орбитали; на каждом уровне их семь. Атомную орбиталь с распределенным по ней зарядом электрона нередко называют электронным облаком.
Потенциалы возбуждения и ионизации
На освобождение электрона от связи с атомным ядром, вследствие чего и происходит образование положительного иона, необходимо затратить определенное количество энергии. Энергия, израсходованная на отрыв электрона, называется работой ионизации. Работа ионизации, выраженная в электронвольтах, называется потенциалом ионизации (электронвольт-единица энергии, которую приобретает электрон, ускоренный электрическим полем с разностью потенциалов в 1 В). Если сообщить связанному электрону газовой молекулы или атома некоторое количество дополнительной энергии, то электрон перейдет на новую орбиту с более высоким энергетическим уровнем, а молекула или атом будут находиться в возбужденном состоянии. Количество энергии, выраженное в электронвольтах, которое необходимо затратить для возбуждения атома или молекулы газа, называется потенциалом возбуждения. Возбужденное состояние атома или молекулы газа является неустойчивым, и электрон может снова возвратиться на стационарную орбиту, а атом или молекула перейдет в нормальное невозбужденное состояние. Энергия возбуждения при этом передается в окружающее пространство в форме светового электромагнитного излучения.
Величина потенциала ионизации и возбуждения зависит от природы атома. Наименьший потенциал ионизации (3,9 эВ) имеют пары цезия, а наибольший (24,5 эВ) наблюдается у газа гелия. У щелочноземельных металлов (цезия, калия, натрия, бария, кальция) связь между электронами и ядром невелика, поэтому они имеют наименьшие потенциалы ионизации, следовательно, на возбуждение и работу выхода электрона потребуется затратить меньше энергии, чем у железа, марганца, меди и никеля. Элементы, имеющие меньшие потенциалы ионизации и возбуждения, чем свариваемый металл, вводят в состав электродных покрытий, чтобы повысить стабилизацию дугового разряда в газах. Количество энергии, которое необходимо для выделения электрона из металла или жидкого тела, называется работой выхода электрона и выражается в электронвольтах.
Водородоподобный атом — атом, содержащий в электронной оболочке один и только один электрон.Таким атомом, кроме водорода и его тяжёлых изотопов (дейтерия и трития), может быть любой ион, если число потерянных им электронов равно заряду атома - 1. Поскольку у такого иона остаётся только один электрон, его и называют водородоподобным атомом. Электронные спектры таких атомов описываются теорией Бора
22. Периодическая система элементов МенделееваПринцип Паули, лежащий в основе систематики заполнения электронных состояний в атомах, позволяет объяснить Периодическую систему элементов Д. И. Менделеева (1869) — фундаментального закона природы, являющегося основой современной химии, атомной и ядерной физики.Д. И. Менделеев ввел понятие порядкового номера Z химического элемента, рав¬ного числу протонов в ядре и соответственно общему числу электронов в электронной оболочке атома. Расположив химические элементы по мере возрастания порядковых номеров, он получил периодичность в изменении химических свойств элементов. Однако для известных в то время 64 химических элементов некоторые клетки таблицы оказались незаполненными, так как соответствующие им элементы (например, Ga, Se, Ос) тогда еще не были известны. Д. И. Менделеев, таким образом, не только правильно расположил известные элементы, но и предсказал существование новых, еще не открытых элементов и их основные свойства. Кроме того, Д. И. Менделееву удалось уточнить атомные веса некоторых элементов. Например, атомные веса Be и U, вычисленные на основе таблицы Менделеева, оказались правильными, а полученные ранее экспериментально — ошибочными.Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для объяснения таблицы будем считать, что каждый последующий элемент образован из предыдущего прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома. Взаимодействием электронов пренебрегаем, внося, где это необходимо, соответствующие поправки. Рассмотрим атомы химических элементов, находящиеся в основном состоянии.Единственный электрон атома водорода находится в состоянии 1s, характеризу¬емом квантовыми числами п=1 , l=0, ml=0 и ms= ½; (ориентация его спина произвольна). Оба электрона атома Не находятся в состоянии 1s, но с антипараллельной ориентацией спина. Электронная конфигурация для атома Не записывается как 1s2(два 1s-электрона). На атоме Не заканчивается заполнение K-оболочки, что соответствует завершению I периода Периодической системы элементов Менделеева.Третий электрон атома Li (Z=3), согласно принципу Паули, уже не может раз-меститься в целиком заполненной K-оболочке и занимает наинизшее энергетическое состояние с n=2 (L-оболочка), т.е. 2s-состояние. Электронная конфигурация для атома Li: 1s22s. Атомом Li начинается II период Периодической системы элементов. Четвертым электроном Be (Z=4) заканчивается заполнение подоболочки 2s. У следующих шести элементов от В (Z=5) до Ne (Z=10) идет заполнение подоболочки 2р (табл. 7). II период Периодической системы заканчивается неоном — инертным газом, для которого подоболочка 2р целиком заполнена.Одиннадцатый электрон Na (Z=11) размещается в М-оболочке (n=3), занимая наинизшее состояние 3s. Электронная конфигурация имеет вид 1s22s22p63s. 3s-Электрон (как и 2s-электрон Li) является валентным электроном, поэтому оптические свойства Na подобны свойствам Li. С Z=12 идет последовательное заполнение M-оболочки. Аr (Z=18) оказывается подобным Не и Ne: в его наружной оболочке все s- и p-состояния заполнены. Аr является химически инертным и завершает III период Периодической системы.Девятнадцатый электрон К (Z=19) должен был бы занять 3d-состоянис в M-оболочке. Однако и в оптическом, и в химическом отношениях атом К схож с атомами Li и Na, которые имеют внешний валентный электрон в s-состоянии. Поэтому 19-й валентный электрон К должен также находиться в s-состоянии, но это может быть только s-состояние новой оболочки (N-оболочки), т. е. заполнение N-обо¬лочки для К начинается при незаполненной M-оболочке. Это означает, что в резуль¬тате взаимодействия электронов состояние n=4, l=0 имеет меньшую энергию, чем состояние n=3, l=2. Спектроскопические и химические свойства Са (Z=20) показыва¬ют, что его 20-й электрон также находится в 4s-состоянии N-оболочки. В последующих элементах происходит заполнение M-оболочки (от Sc (Z=21) до Zn (Z=30)). Далее N-оболочка заполняется до Кr (Z=36), у которого опять-таки, как и в случае Ne и Аr,s- и p-состояния наружной оболочки заполнены целиком. Криптоном заканчивается IV период Периодической системы. Подобные рассуждения применимы и к остальным элементам таблицы Менделеева, однако эти данные можно найти в справочниках. Отметим лишь, что и начальные элементы последующих периодов Rb, Cs, Fr являются щелочными металлами, а их последний электрон находится в s-состоянии. Кроме того, атомы инертных газов (Не, Ne, Ar, Кr, Хе, Rn) занимают в таблице особое положение — в каждом из них s- и p-состояния наружной оболочки целиком заполнены и ими завершаются очередные периоды Периодической системы.Каждую из двух групп элементов — лантаниды (от лантана (Z=57) до лютеция (Z=71)) и актиниды (от актиния (Z=89) до лоуренсия (Z=103)) — приходится поме¬щать в одну клетку таблицы, так как химические свойства элементов в пределах этих групп очень близки. Это объясняется тем, что для лантанидов заполнение подоболочки 4f, которая может содержать 14 электронов, начинается лишь после того, как целиком заполнятся подоболочки 5s, 5p и 6s. Поэтому для этих элементов внешняя P-оболочка (6s2) оказывается одинаковой. Аналогично, одинаковой для актинидов является Q-оболочка (7s2).Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов. Так, инертные газы имеют одинаковые внешние оболочки из 8 электронов (заполненные s- и p-состояния); во внешней оболочке щелочных металлов (Li, Na, К, Rb, Cs, Fr) имеется лишь один s-электрон; во внешней оболочке щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra) имеется два s-электрона; галоиды (F, О, Br, I, At) имеют внешние оболочки, в которых недостает одного электрона до оболочки инертного газа, и т. д.
