- •Курс лекций: Общая энергетика.
- •Предмет, метод, основные понятия, определение термодинамики.
- •Основные параметры состояния абсолютная температура, абсолютное давление.
- •Основные термодинамические процессы
- •Круговые термодинамические процессы (циклы).
- •Эксергия.
- •Водяной пар.
- •Газотурбинные установки. Цикл Брайтона.
- •Паротурбинные установки. Цикл Ренкина.
- •Показатели фиктивности теплофикации.
- •Теплообмен Излучения (Лучистый теплообмен).
- •Основные законы теплового излучения.
- •Теплообменные аппараты.
- •Энергетическое топливо.
- •Полиугольные топки.
- •Паровые котлы
- •Тепловой процесс турбинной ступени
- •Паровые турбины.
- •Реактивные установки ас.
- •Современное состояние ээ
- •Современное состояние гидроэнергетики
- •Работа вводного потока схема концентрации напора.
- •Гидравлические турбины.
Основные термодинамические процессы
Изохорный процесс протекает при постоянном объеме V=const
Закон Шарля


V
P

Изобарный процесс P=const
Закон Гей-Люссака

P
V

Изотермический процесс T=const
Закон Бойля-Мариотти


V
P
Адиабатный процесс
Без теплообмена с окружающей средой q=0

k - показатель адиабаты
Для идеального газа:

Для всех остальных газов:

 -
Энтапия
-
Энтапия
 -
Энтропия
-
Энтропия
Политропный процесс
n – показатель политропы.

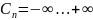





Внутренняя энергия и энтальпия.
Экстенсивные калорические параметры.


Составляющие энтальпии:
Кинетическая энергия микрочастиц,
Потенциальная энергия взаимодействия микрочастиц,
Энергия электронных оболочек атомов,
Внутренняя энергия.
Величина внутренней энергии определяется параметрами состояния вещества, поэтому внутренней энергией является функция состояния.



Изменение внутренней энергии:

Для идеального газа:

Энтальпия - совокупность внутренней энергии и потенциальной энергии внешнего давления.


Энтальпия является функцией состояния:



Для идеального газа:


Величина внутренней энергии выбирается произвольно для газа, точка отсчёта является нормальным условием воды тройную точку.
Рассматривают расширенную систему:




F
Z
P
m


Первый закон термодинамики.
Формулировка:
Теплота переданной термодинамической системой расходуется на увеличение внутренней энергии и совершение работы.
Аналитическое выражение:



Получим выражения первого закона термодинамики по 2-ой формуле через энтальпии, преобразуем его:

Уравнение термодинамики для конечного процесса:
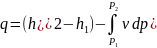
Располагаемая работа:


Энтропия.
Энтропия – мера деградации энергии вещества в элементарном обратимом термодинамическом процессе.

Энтропия изолируемой системы не изменяется, если в системе пробегают обратимые процессы и энтропия растёт, когда в системе пробегают необратимые системы.
Переход термодинамической системы по неравноместному состоянию к равноместному сопровождается ростом энтропии.
Энтропия сложной системы равна сумме энтропий компонентов.
Энтропия есть свойство состояния
Изменение энтропии в различных процессах.
Энтропия идеального газа:


Полученную формулу преобразуем:
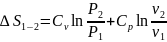

Если условно принять точку отсчёта энтропии, то можно вычислить абсолютную
энтропию газа при любых параметрах состояния. За точку отсчёта принимают нормальные условия.
Энтропия в разных процессах:
Изохорный:

Изобарный:

Изотермический:

Адиабатный:

Политропный:

T,S – Диаграмма
T, K
S,
Дж/кг





V
= const (изохора)
S,
Дж/кг
T, K
P
= const (изобара)

T
=
const
(изотерма)
q
= 0 (адиабата)