
- •1. Атомы, входящие в состав молекулы органического веще-
- •2. От строения молекул, т. Е. От того, в каком порядке
- •13) Циклоалканы(циклопарафины)
- •Гидратация
- •Гидрирование-
- •Реакция карбонилирования- Алкены в присутствии катализатора, высокой температуры и давления присоединяют co и h2 с образованием альдегидов]
- •Реакции электрофильного присоединения
- •2)Реакции гидрогалогенирования
- •3)Реакции карбонилирования , где х: он, or, ocor, nh2 и Пр. ,
- •22)Реакции циклобразования
- •24)Реакции образования гетероциклов
- •21) Получение
- •Реакции sn1
21) Получение
Бутадиен получают по реакции Лебедева пропусканием этилового спирта через катализатор:
2CH3CH2OH → C4H6 + 2H2O + H2. Или дегидрогенизацией нормального бутилена: CH2=CH—CH2—CH3 → CH2=CH—CH=CH2 + Н2
Хлоропрен (хлорбутадиен, 2-хлор-1,3-бутадиен), СН2=ССlСН=СН2 — бесцветная жидкость, tкип 59,4 °C. Сырье для получения хлорпреновых каучуков. Также известен под названием неопрен Получение из ацетилена через винилацетилен.
![]()
ИЗОПРЕН (2-метилбута-1,3-диен, СН2=С(СН3)СН=СН2), органическое химическое соединение. Синтетический продукт, очень напоминающий натуральную РЕЗИНУ. Натуральный каучук является полимером изопрена. В качестве примесей содержит несколько процентов других материалов, таких как белки, жирные кислоты, смолы и неорганические вещества. Некоторые источники натурального каучука называются гуттаперча и состоит из транс-1,4-полиизопрена, структурный изомер, который имеет схожие, но не идентичные свойства. Изопрен производится и выделяется в атмосферу многими видами деревьев. После попадания в атмосферу изопрен превращается свободными радикалами (такими как гидроксил (OH) радикал) и в меньшей мере озоном в различные вещества, такие как альдегиды, гидроксипероксиды, органические нитраты и эпоксиды, которые смешиваются с водными каплями, образуя аэрозоли или дымку. Этот механизм деревья используют не только для того, чтобы избежать перегрева листьев Солнцем, но и для защиты от свободных радикалов, особенно озона. Изопрен впервые был получен термической обработкой натурального каучука. Наиболее промышленно доступен как продукт термического крекинга лигроина или масла, а также как побочный продукт при производстве этилена. Около 95% производства изопрена используется для производства цис-1,4-полиизопрена — синтетического варианта природного каучука.
22) . Реакции ароматических углеводородов- Наиболее характерны для ароматических углеводородов реакции замещения. При этом в результате реакций не происходит разрушения ароматического секстета электронов. Известны также многочисленные примеры реакций радикального галогенирования и окисления боковых цепей алкилбензолов. Процессы, в которых разрушается стабильная ароматическая система, мало характерны.Электрофильное ароматическое замещение (SEAr)
А. Механизм SEAr Электрофильное замещение в ароматическом ядре является одной из наиболее хорошо изученных и широко распространенных органических реакций.Конечным результатом электрофильного замещения является замещение атома водорода в ароматическом ядре на другой атом или группу атомов:
![]()
Реакции
электрофильного замещения в ароматическом
ядре (как и реакции электрофильного присоединения к
С=С связи) начинаются с образования ![]() -комплекса -
электрофильный агент координируется
с молекулой бензола за счет
-электронной
системы последнего:
-комплекса -
электрофильный агент координируется
с молекулой бензола за счет
-электронной
системы последнего:
![]()
В
бензольном ядре
-система,
будучи устойчивой, не нарушается столь
легко, как в алкенах. Поэтому
соответствующий
-комплекс
может быть не только зафиксирован с
помощью физико-химических методов, но
и выделен.
Стадия образования
-комплекса
протекает быстро и не лимитирует скорости всего
процесса. Ароматическая система
нарушается, и возникает ковалентная
связь электрофила с атомом углерода
бензольного ядра. При этом
-комплекс
превращается в карбокатион), в котором
положительный заряд делокализован в
диеновой системе, а атакованный
электрофилом атом углерода переходит
из sp2- в sp3-гибридное
состояние. Такой катион
называется ![]() -комплексом.
Как правило, стадия
образования
-комплекса
является скорость определяющей.:
При электрофильном присоединении к
алкенам также сначала образуется
-комплекс,
переходящий затем в
-комплекс,
однако дальнейшая судьба
-комплекса
в случае электрофильных реакций алкенов
и аренов различна.
-Комплекс,
образующийся из алкенов, стабилизируется
за счет транс-присоединения
нуклеофила;
-комплекс,
формирующийся из ароматической системы,
стабилизируется с регенерацией
ароматического секстета
-электронов.Реакции
SЕAr,
по результату представляющие
собой замещение,
на самом деле по
механизму являются реакциями присоединения
с последующим отщеплением.
Б.
Ориентация присоединения в монозамещенных
бензолахПри
рассмотрении реакций электрофильного
замещения в монозамещенных бензолах
возникает две проблемы: 1. Новый
заместитель может вступать в орто-, мета-
или пара-положения,
а также замещать уже имеющийся
заместитель).
2. Скорость замещения
может быть больше или меньше скорости
замещения в бензоле. Влияние имеющегося
в бензольном кольце заместителя можно
объяснить исходя из его электронных
эффектов. По этому признаку заместители
можно разделить на 3 основных группы:
1. Заместители, ускоряющие реакцию по
сравнению с незамещенным бензолом
(активирующие)
и направляющие замещение в орто,-пара-
положения.
2. Заместители, замедляющие реакцию
(дезактивирующие)
и направляющие замещение в орто,-пара-
положения.
3. Заместители, замедляющие реакцию
(дезактивирующие)
и направляющие замещение в мета-
положения.
Заместители, отмеченные в п.п. 1,2
(орто-,пара-ориентанты)
называются заместителями
I-го рода ;
отмеченные в п.3 (мета-ориентанты)
- заместителями
II-го рода .
Ниже приведено отнесение обычно
встречающихся заместителей в соотвествие
с их электронными эффектами. Ориентанты
I-го рода (орто-,
пара-)
активирующие
Все алкильные группы; -СH2Hal,
-OH, -OR, -O-,
-OC(O)R,-NH2,
-NHR
NR2,
NHC(O)R,
- дезактивирующие-
Галогены: F,
Cl,
Br,
I,
Ориентанты
II-го рода (мета-)
дезактивирующие--CHHal2,
-СHal3,
-N+R3,
-C(O)H,
-C(O)R,
-CN,
-SO3H,
C(O)OH,-C(O)OR,
NO2
Электрофильное замещение будет
происходить тем
быстрее, чем более электронодонорным
является заместитель в ядре,
и тем
медленнее, чем более электроноакцепторным
является заместитель в ядре;
динамического
эффект,
т.е. распределения электронной плотности
в реагирующей молекуле. Ориентацию
электрофильного замещения в монозамещенных
бензолах можно объяснить и с
позиции статических электронных
эффектов -
распределения электронной плотности
в нереагирующей молекуле. При рассмотрении
смещения электронной плотности по
кратным связям можно заметить, что при
наличии электронодонорного заместителя
более всего повышена электронная
плотность в орто-
и пара-
положениях, а при наличии электроноакцепторного
заместителя эти положения
наиболее обеднены электронами:
-комплексом.
Как правило, стадия
образования
-комплекса
является скорость определяющей.:
При электрофильном присоединении к
алкенам также сначала образуется
-комплекс,
переходящий затем в
-комплекс,
однако дальнейшая судьба
-комплекса
в случае электрофильных реакций алкенов
и аренов различна.
-Комплекс,
образующийся из алкенов, стабилизируется
за счет транс-присоединения
нуклеофила;
-комплекс,
формирующийся из ароматической системы,
стабилизируется с регенерацией
ароматического секстета
-электронов.Реакции
SЕAr,
по результату представляющие
собой замещение,
на самом деле по
механизму являются реакциями присоединения
с последующим отщеплением.
Б.
Ориентация присоединения в монозамещенных
бензолахПри
рассмотрении реакций электрофильного
замещения в монозамещенных бензолах
возникает две проблемы: 1. Новый
заместитель может вступать в орто-, мета-
или пара-положения,
а также замещать уже имеющийся
заместитель).
2. Скорость замещения
может быть больше или меньше скорости
замещения в бензоле. Влияние имеющегося
в бензольном кольце заместителя можно
объяснить исходя из его электронных
эффектов. По этому признаку заместители
можно разделить на 3 основных группы:
1. Заместители, ускоряющие реакцию по
сравнению с незамещенным бензолом
(активирующие)
и направляющие замещение в орто,-пара-
положения.
2. Заместители, замедляющие реакцию
(дезактивирующие)
и направляющие замещение в орто,-пара-
положения.
3. Заместители, замедляющие реакцию
(дезактивирующие)
и направляющие замещение в мета-
положения.
Заместители, отмеченные в п.п. 1,2
(орто-,пара-ориентанты)
называются заместителями
I-го рода ;
отмеченные в п.3 (мета-ориентанты)
- заместителями
II-го рода .
Ниже приведено отнесение обычно
встречающихся заместителей в соотвествие
с их электронными эффектами. Ориентанты
I-го рода (орто-,
пара-)
активирующие
Все алкильные группы; -СH2Hal,
-OH, -OR, -O-,
-OC(O)R,-NH2,
-NHR
NR2,
NHC(O)R,
- дезактивирующие-
Галогены: F,
Cl,
Br,
I,
Ориентанты
II-го рода (мета-)
дезактивирующие--CHHal2,
-СHal3,
-N+R3,
-C(O)H,
-C(O)R,
-CN,
-SO3H,
C(O)OH,-C(O)OR,
NO2
Электрофильное замещение будет
происходить тем
быстрее, чем более электронодонорным
является заместитель в ядре,
и тем
медленнее, чем более электроноакцепторным
является заместитель в ядре;
динамического
эффект,
т.е. распределения электронной плотности
в реагирующей молекуле. Ориентацию
электрофильного замещения в монозамещенных
бензолах можно объяснить и с
позиции статических электронных
эффектов -
распределения электронной плотности
в нереагирующей молекуле. При рассмотрении
смещения электронной плотности по
кратным связям можно заметить, что при
наличии электронодонорного заместителя
более всего повышена электронная
плотность в орто-
и пара-
положениях, а при наличии электроноакцепторного
заместителя эти положения
наиболее обеднены электронами:
Особый
случай представляют собой галогены -
являясь заместителями в бензольном
ядре, они дезактивируют его в реакциях
электрофильного замещения, однако
являются орто-, пара-ориентантами.
Дезактивация связана с тем, что, в
отличие других группировок с неподеленными
электронными парами (таких как -OH, -NH2 и
т.п.), обладающих положительным мезомерным
(+М) и отрицательным индуктивным эффектом
(-I), для галогенов характерно преобладание
индуктивного эффекта над мезомерным
(+М< -I).
![]() В
то же время, атомы галогенов
являются орто,пара-ориентантами,
поскольку способны за счет положительного
мезомерного эффекта участвовать в
делокализации положительного заряда
в
-комплексе,
образующемся при орто-
или пара-
атаке, и тем самым снижают энергию его
образования. Если в бензольном ядре
имеется не один, а два заместителя, то
их ориентирующее действие может
совпадать (согласованная
ориентация)
или не совпадать (несогласованная
ориентация). В
первом случае можно рассчитывать на
преимущественное образование каких-то
определенных изомеров, а во втором
будут получаться сложные смеси.
В
то же время, атомы галогенов
являются орто,пара-ориентантами,
поскольку способны за счет положительного
мезомерного эффекта участвовать в
делокализации положительного заряда
в
-комплексе,
образующемся при орто-
или пара-
атаке, и тем самым снижают энергию его
образования. Если в бензольном ядре
имеется не один, а два заместителя, то
их ориентирующее действие может
совпадать (согласованная
ориентация)
или не совпадать (несогласованная
ориентация). В
первом случае можно рассчитывать на
преимущественное образование каких-то
определенных изомеров, а во втором
будут получаться сложные смеси.
23) Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов.Токсичен, канцерогенен. Химические свойства- Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление). 1)Взаимодействие с хлором в присутствии катализатора:С6H6 + Cl2 -(FeCl3)→ С6H5Cl + HCl образуется хлорбензол. Катализаторы содействуют созданию активной электрофильной частицы путём поляризации между атомами галогена. Cl-Cl + FeCl3 → Clઠ-[FeCl4]ઠ+ С6H6 + Clઠ--Clઠ+ + FeCl3 → [С6H5Cl + FeCl4] → С6H5Cl + FeCl3 + HCl. В отсутствие катализатора при нагревании или освещении идёт радикальная реакция замещения: С6H6 + 3Cl2 -(освещение)→ C6H6Cl6 образуется смесь изомеров гексахлорциклогексана 2)Взаимодействие с бромом (чистый): С6H6 + Br2 -(FeBr3 или AlCl3)→ С6H5Br + HBr образуется бромбензол3)Взаимодействие с галогенопроизводными алканов (реакция Фриделя-Крафтса): С6H6 + С2H5Cl -(AlCl3)→ С6H5С2H5 + HCl образуется этилбензол, С6H6 + HNO3 -(H2SO4)→ С6H5NO2 + H2O
24) Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей. Все шесть атомов углерода в молекуле бензола находятся в sp 2-гибридном состоянии. Каждый атом углерода образует σ -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя σ -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (σ -скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ -скелету и параллельно друг другу. Все шесть электронов взаимодействуют между собой, образуя π -связи, не локализованные в пары как при образовании двойных связей, а объединенные в единое π -электронное облако.Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая π -электронная плотность в этой сопряженной системе располагается над и под плоскостью σ -скелета). В результате все связи между атомами углерода в бензоле выровнены и имеют длину0,139нм. Равноценность связей принто изображать кружком внутри цикла. Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола. Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения, — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях. Номенклатура и изомерия. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные(полиядерные) арены (простейший Гомологический ряд бензола отвечает общей формуле С6Н2n-6. Структурная изомерия в гомологическом ряду бензола обусловлена взаимнымрасположением заместителей в ядре. Монозамещенные производные бензола не имеют изомеровположения, так как все атомы в бензольном ядре равноценны. Дизамещенные производныесуществуют в виде трех изомеров, из них — нафталин)различающихся взаимным расположением заместителей. Положение заместителейуказывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-). Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5— называется фенил Ароматическими являются молекулы, подчиняющиеся правилу Хюккеля: ароматической является плоская моноциклическая сопряженная система, содержащая (4n + 2)π-электронов (где n = 0,1,2…) Ароматические гетероциклы Все многообразие ароматических гетероциклических соединений может быть формально произведено из карбоциклических ароматических соединений двумя способами. 1-ый способ: =СН-группа карбоцикла заменяется на гетероатом, способный предоставить в ароматическую систему один электрон, находящийся на р-орбитали, перпендикулярной плоскости цикла. К гетероатомам и группам, изоэлектронным =СН-группе, относятся: =N-, =N+-R, =O+-, =S+-. Замена =СН-группы в бензоле на эти группы приводит к шестичленным гетероциклам: пиридину , ионам пиридиния, пирилия и тиопирилия. 2-ой способ: замена фрагмента -СН=СН- на гетероатом, имеющий неподеленную пару р-электронов, которая принимает участие в создании ароматической -электронной системы. Например, группировка -СН=СН- в бензоле может быть заменена на гетероатомы и группы: -O-, -S-, -Se-, -NH-, -NR-. Такая замена приводит к наиболее известным пятичленным гетероциклам: фурану,тиофену, селенофену и пирролу.
 Введение
гетероатома в карбоциклическую
ароматическую систему не нарушает
замкнутости электронной оболочки, но
значительно отражается на распределении
электронной плотности и, как следствие
на реакционной способности.
Конденсированные
ароматические углеводороды- Правило
Хюккеля об ароматичности (4n+2)
-электронной
системы выведено для моноциклических
систем. На полициклические конденсированные
(т.е. содержащие несколько бензольных
колец с общими вершинами) системы оно
может быть перенесено для систем,
имеющих атомы, общие для двух циклов,
например, для показанных ниже нафталина,
антрацена, фенантрена, бифенилена:
Введение
гетероатома в карбоциклическую
ароматическую систему не нарушает
замкнутости электронной оболочки, но
значительно отражается на распределении
электронной плотности и, как следствие
на реакционной способности.
Конденсированные
ароматические углеводороды- Правило
Хюккеля об ароматичности (4n+2)
-электронной
системы выведено для моноциклических
систем. На полициклические конденсированные
(т.е. содержащие несколько бензольных
колец с общими вершинами) системы оно
может быть перенесено для систем,
имеющих атомы, общие для двух циклов,
например, для показанных ниже нафталина,
антрацена, фенантрена, бифенилена:
|
|
|
|
нафталин |
фенантрен |
антрацен |
бифенилен |
Для соединений, имеющих хотя бы один атом, общий для трех циклов (например для пирена), правило Хюккеля неприменимо.
![]() Реакционная
способность конденсированных
ароматических углеводородов несколько
повышена по сравнению с моноциклическими
аренами: они легче окисляются и
восстанавливаются, вступают в реакции
присоединения и замещения.
Реакционная
способность конденсированных
ароматических углеводородов несколько
повышена по сравнению с моноциклическими
аренами: они легче окисляются и
восстанавливаются, вступают в реакции
присоединения и замещения.
25)АРЕНЫ (ароматические углеводороды) Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Простейшие представители (одноядерные арены):
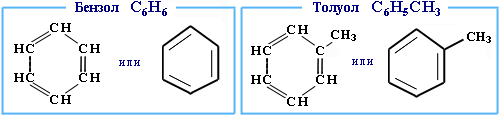
Многоядерные арены: нафталин С10Н8, антрацен С14Н10 и др.

Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Но понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе.
Критерии ароматичности аренов:1)Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему.2)Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).3)Замкнутая система сопряженных связей содержит 4n+2 π-электронов (n – целое число). Этим критериям полностью соответствует молекула бензола С6Н6. Получение. 1)Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производится на коксохимических и газовых заводах. 2)Реакция превращения циклогексана в бензол (дегидрогенизация или дегидрирование) протекает при пропускании его над катализатором при 300°С. Предельные углеводороды реакцией дегидрогенизации также можно превращать в ароматические. Например:
![]()
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга.
Бензол
можно получить, пропуская ацетилен
через нагретую до 600° С трубку с
активированным углем. Весь процесс
полимеризации трех молекул ацетилена
можно изобразить схемой
26 При замещении в углеводородах одного или нескольких атомов водорода на атомы фтора, хлора, брома или иода получаются соединения, которые называются галоидными производными: фтористыми, хлористыми, бромистыми и йодистыми. В зависимости от того, один или два, три и т. д. атомаводорода замещены на атомы галоида, различают одногалоидные (моногалоидные), дигалоидные, тригалоидные и многогалоидные (полигалоидные) производные.При замещении в молекуле метана одного атома водорода на атом галоида получаются соединения СН3Cl, CH3Br, CH3J. При замещении на галоидодного атома водорода в молекуле этана может получиться также только одно моногалоидное соединение строения СН3—СН2Cl. Если же вмолекуле пропана СН3—СН2—СН3 заменить на галоид один атом водорода в одной из метильных групп или в метиленовой группе, то можно получить два изомерных соединения:
![]()
![]()
От каждого из двух изомерных бутанов можно произвести по два изомерных моногалоидных соединения:
![]() Наиболее
распространенным способом
получения
галоидных алкилов является обмен
гидроксильной группы спиртов на галоид.
Этот обмен может быть осуществлен при
действии концентрированных
галоидоводородных кислот на спирты.
Это
показывают, каким образом следует
практически осуществлять процесс
этерификации, чтобы добиться
удовлетворительных выходов галоидного
алкила, а также максимально использовать
спирт и галоидоводородную кислоту: для
этой цели необходимо следить за тем,
чтобы вода по возможности отсутствовала
в реакционной массе. Этого достигают
применением безводного спирта и
безводного галоидоводорода. Во многих
случаях оказывается целесообразным
связывать образующуюся при реакции
воду с помощью водоотнимающих веществ,
н-р серной кислоты или хлористого цинка.
Проведенная таким образом этерификация
спиртов галоидоводородными кислотами
представляет собой хороший препаративный
метод получения галоидных алкилов. Замещение
гидроксильной группы в простейших
фенолах при действии хлористых и
бромистых соединений фосфора протекает
«не гладко; обычно лишь сравнительно
небольшое количество фенола превращается
при этом в галоидное производное.
Реакция эта облегчается при наличии в
ядре нитрогруппы. Следует отметить,
что реакция между р-нафтолом и хлористыми
или бромистыми соединениями фосфора
может быть использована как удобный
способ получения галоидных производных
нафталина.
Наиболее
распространенным способом
получения
галоидных алкилов является обмен
гидроксильной группы спиртов на галоид.
Этот обмен может быть осуществлен при
действии концентрированных
галоидоводородных кислот на спирты.
Это
показывают, каким образом следует
практически осуществлять процесс
этерификации, чтобы добиться
удовлетворительных выходов галоидного
алкила, а также максимально использовать
спирт и галоидоводородную кислоту: для
этой цели необходимо следить за тем,
чтобы вода по возможности отсутствовала
в реакционной массе. Этого достигают
применением безводного спирта и
безводного галоидоводорода. Во многих
случаях оказывается целесообразным
связывать образующуюся при реакции
воду с помощью водоотнимающих веществ,
н-р серной кислоты или хлористого цинка.
Проведенная таким образом этерификация
спиртов галоидоводородными кислотами
представляет собой хороший препаративный
метод получения галоидных алкилов. Замещение
гидроксильной группы в простейших
фенолах при действии хлористых и
бромистых соединений фосфора протекает
«не гладко; обычно лишь сравнительно
небольшое количество фенола превращается
при этом в галоидное производное.
Реакция эта облегчается при наличии в
ядре нитрогруппы. Следует отметить,
что реакция между р-нафтолом и хлористыми
или бромистыми соединениями фосфора
может быть использована как удобный
способ получения галоидных производных
нафталина.
29) Реакции нуклеофильного замещения— реакции замещения, в которых атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару. Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все нуклеофилы являются основаниями Льюиса. Общий вид реакций нуклеофильного замещения: R−X + Y− → R−Y + X− (анионный нуклеофил) R−X + Y−Z → R−Y + X−Z (нейтральный нуклеофил) Выделяют реакции алифатического (широко распространены) и ароматического (мало распространены) нуклеофильного замещения. Реакции алифатического нуклеофильного замещения играют крайне важную роль в органическом синтезе и широко используются как в лабораторной практике, так и промышленности.
