
- •1. Атомы, входящие в состав молекулы органического веще-
- •2. От строения молекул, т. Е. От того, в каком порядке
- •13) Циклоалканы(циклопарафины)
- •Гидратация
- •Гидрирование-
- •Реакция карбонилирования- Алкены в присутствии катализатора, высокой температуры и давления присоединяют co и h2 с образованием альдегидов]
- •Реакции электрофильного присоединения
- •2)Реакции гидрогалогенирования
- •3)Реакции карбонилирования , где х: он, or, ocor, nh2 и Пр. ,
- •22)Реакции циклобразования
- •24)Реакции образования гетероциклов
- •21) Получение
- •Реакции sn1
1)Чаще всего органические реакции классифицируют по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций — радикальные и ионные.Радикальные реакции — это процессы, идущие с гемолитическим разрывом ковалентной связи.При гемолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гемолитического разрыва образуются свободные радикалы:X:Y→X.+.Y.Нейтральный атом или частица с неспаренным электроном называется свободным радикалом.Ионные реакции — это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц.X:Y → X+ + :Y-В результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная. Нуклеофильная частица (нуклеофил) — это частица, имеющая пару электронов на внешнем электронном уровне. За счет пары электронов нуклеофил способен образовывать новую ковалентную связь.Электрофильная частица (электрофил) - это частица, имеющая свободную орбиталь на внешнем электронном уровне. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи за счет электронов той частицы, с которой он взаимодействует.Частица с положительным зарядом на атоме углерода называется карбокатионом. Согласно другой классификации, органические реакции делятся на термические, являющиеся результатом столкновений молекул при их тепловом движении, и фотохимические, при которых молекулы, поглощая квант света Av, переходят в более высокие энергетические состояния и далее подвергаются химическим превращениям. Для одних и тех же исходных соединений термические и фотохимические реакции обычно приводят к различным продуктам.Примером здесь является термическое и фотохимическое хлорирование бензола — в первом случае образуется хлорбензол, во втором случае — гексахлорциклогексан.Реакции часто классифицируются так же, как и в неорганической химии — по структурному признаку.В органической химии все структурные изменения рассматриваются относительно атома (или атомов) углерода, участвующих в реакции.Часто встречаются следующие типы превращений:1) присоединение R-CH=CH2 + XY→ RCHX-CH2Y;2) замещение R-CH2X + Y→ R-CH2Y + X;3) отщепление R-CHX-CH2Y→ R-CH=CH2 + XY; (элиминирование)4) полимеризация n(СН2=СН2) → (—CH2—СН2—)n. В большинстве случаев элиминируемая молекула образуется при соединении двух частиц, отщепленных от соседних атомов углерода. Такой процесс называется 1,2-элиминированием.Кроме приведенных четырех типов простейших механизмов, реакций на практике употребляются еще следующие обозначения Окисление — реакция, при которой под действием окисляющего реагента вещество соединяется с кислородом (либо другим электроотрицательным элементом, например, галогеном) или теряет водород (в виде воды или молекулярного водорода)CH3CHO →CH3COOH ; CH3OH →CH2O + H2; CH3OH→CH2O + H2 Отщепление водорода в последнем примере называется дегидрированием и проводится с помощью катализатора.Восстановление - реакция, обратная окислению. Под действием восстанавливающего реагента соединение принимает атомы водорода или теряет атомы кислорода:CH3COCH3 →CH3CH(OH)CH3 Гидрирование - реакция, представляющая собой частный случай восстановления. Водород присоединяется к кратной связи или ароматическому ядру в присутствии катализатора. Конденсация — реакция, при которой происходит рост цепи. Сначала происходит присоединение, за которым обычно следует элиминирование.Пиролиз — реакция, при которой соединение подвергается термическому разложению без доступа воздуха (и обычно при пониженном давлении) с образованием одного или нескольких продуктов. Примером пиролиза может служить термическое разложение каменного угля. Иногда вместо пиролиза употребляется термин "сухая перегонка" ;Некоторые реакции получают свои названия по продуктам, к которым они приводят. Так, если в молекулу вводится метильная группа, то говорят о метилировании, если ацетил — то об ацетилировании, если хлор — то о хлорировании и т.д.
2) ИЗОМЕРИЗАЦИЯ – превращение одного изомера в другой. Изомеризация приводит к получению соединения с иным расположением атомов или групп, но при этом не происходит изменение состава и молекулярной массы соединения
СТРУКТУРНАЯ ИЗОМЕРИЯ-имеют одинаковый кол-ный и кач.-ный состав,но отл.химич.строением, т.е.порядком соед.атомов в молекуле. Они проявл.разные св.-ва: СН3-СН2-СН2-СН3-н-бутан и СН3-СН(СН3)-СН3-изобутан, структ.изомеры отл.физико-химич.хар.-ми, т.е. сущ.как индивид.строения и не превразщаются друг в друга без разрыва ковалентной связей.Различия в свойствах вызваны разной степенью взаимного влияния групп атомов в этих молекулах, расстоянием между атомами и группами, и степенью взаимного влияния.Виды стр.изомерии-1)изомерия углеорд.скелета(н-бутан и изобутан);2)изом.полож.функц.группы:СН3-СН2-СН2-ОН-пропиловый спирт, и СН3-СН(ОН)-СН3-изопропилов.спирт;3)изомерия положен.кратных связей:СН2=СН-СН2-СН3-1-бутен, и сн3-сн=сн-сн2-бутен-2; 4)изом.связан.с принадлежностью к разным классам орг.соед.:сн3-сн2-он-этиловый спирт и сн3-о-сн3-диметиловый эфир; 5)метамерия-изомерия радикалов: сн3-сн2-о-сн2-сн3-диэтиловый эфир и сн3-о-сн2-сн2-сн3-метилпропиловый эфир; 6)таутомерия-изомеры превращаются друг в друга путем перемещения атомов или групп внутри мрлекулы: Н:СН2-N(O)=O-нитрометан↔CH2=N(O)-O-H-аци-форма, таутомеры реально существуют. Они самопрозвольно превращаются друг в друга, находясь в динамическом равновесии, и это превращение не требует каких-либо специальных условий.Стериоизомерия-имеют одинаковое химич.строение, но разное расположение атомов в пространстве, 2 вида стериоизомерии-конформационная и конфигурационная; конформационная-возни кает при вращении групп атомов вокруг простой ɕ-связи.поворотные изомеры отличаются расположением атомов , не связанных друг с другом.простая ɕ-связь допускает свободное вращение групп атомов вокруг своей оси.поворотные изомеры, возникающие при вращении групп вокруг простой связи, называют конформациями, их принято изображать в виде пространственных структур или их проекций(проекции ньюмена). Энергетическим минимумам отвечают пространственные структуры с максимально удаленными друг от друга атомами.пространственные стр-ры, отвечающие минимуму энергии на потенциальной кривой-конфермерами, формы, обладающие наиболее низкой энергией-затормеженные, более высокоэнергетические-заслоненные. Конфигурационная изом.облад.определенным расположением атомов в пространстве, которое не зависит от свободного вращения вокруг простых связей. Расположение атомов в пространстве, приводящее к появл.стериоизомерии, называют конфигурацией, ав соответств.пространств.изомеры-конфигурационными. Они не способны превращаться друг в друга без разрыва химич.св., 2 вида: геометрическая(цис-, транс-) оптическая.геометрическая-условием для возникновения геом.изомера явл.отсутствие вращения вокруг связи, затрудненность впащения-в молекулах ациклических соед., где поворот требует разрыва связей в цикле,затрудненность вращения вокруг двойной связи у алкенов, им.разные заместители по концам двойной связи, приводит к возникновению 2 конфигураций, отл.положением заместителей относительно двойной связи.если оба заместителя располаг.по одну сторону от 2-ой связи, его называют цис-изомером, если по разные стороны-транс-изомером.отличия в св-вахгеом.изомеров вызваны различ.расстояниями между группами атомов возле лвойной связи и различ.степенью взаимод.между соответств.группами и атомами. У транс-изомера заместители максимально удалены др.от др.и испытывают наимен.взаимное отталкивание, тогда как в цис-изомере они сближены, и взаимод.их выражено в наибольшей степени. Поэтому геом.ихомеры обладают разными физико-химич.св-ми. Превращение изомеров друг в друга при обычных усл.не возможно без разрыва двойной связи. Поэтому цис-транс-изомеры существ.как индивид.соед. транс изомеры более энергетич.устойчивы вследствие наименьшего взаимного отталкивания заместителей. Оптическая изомерия-вид пространственной изомерии, обусловлен пространственной ассиметрией молекул. Такие молекулы при одинаковом химич.строении не могут быть совмещены в пространстве не при каких поворотах. Асимметрич.молек.называют хиральными. Хиральные молекулы не совместимы в пространстве и часто относятся др.к другу как предмет и его зеркальное отражение. Хиральные молекулы им.элемент асимметрии, которым может служить центр(например, атом углерода)ось или плоскость симметрии). Хиральные молекулы обладают способностью поворачивать плоскость поляризованного света на опред.угол α. Это явл.назыв.оптич.активн., а соответств.молекулы оптич.активными. Оптич. изомеры, вращающ. Плоскость поляризации вправо,назыв.правовращающими и обознач. значком «+», влево-левовращающ. И обознач».- «. Хиральные органич.молек.имеют центр асимметрии-асимметрический или хиральный центр. часто это атом углерода,связанный с 4 различными углерод.атомами.
3) В основе лежит теория хи-
мического строения Бутлерова. Предпосылками к появлению этой теории явились теории радика-
лов и типов, а также введение фундаментальных понятий химии: атом,
молекула, эквивалент.
1. Атомы, входящие в состав молекулы органического веще-
ства, не находятся в беспорядочном состоянии, а соединены
между собой в определенной последовательности химическими
связями (согласно валентности этих атомов).
2. От строения молекул, т. Е. От того, в каком порядке
соединены между собой атомы в молекуле, зависят свойства
вещества.3. Зная свойства вещества, можно установить его строение,
и, наоборот, химическое строение органического соединения
может многое сказать о его свойствах.4. Химические свойства атомов и атомных группировок не
являются постоянными, а зависят от других атомов (атомных
групп), находящихся в молекуле. При этом наиболее сильное
влияние атомов наблюдается в том случае, если они связаны
друг с другом непосредственно.
5. Строение молекулы можно выразить при помощи
структурной формулы, которая для данного вещества является
единственной.
Связи между атомами в органических соединениях равноцен-
ны. Это объясняется теорией гибридизации орбиталей (см. раздел
«Строение вещества»). Для атома углерода возможны три валент-
ных состояния с различными типами гибридизации: sp3-, sp2- и sp.
При sp3-гибридизации происходит смешение одной 2s- и трех 2р-
орбиталей: Электронные орбитали атома углерода
в первом валентном состоянии
sp3
В результате образуются четыре одинаковые гибридные орбитали,
имеющие большую электронную плотность по одну сторону ядра.
Поэтому каждая из гиб-
ридных орбиталей в
большей степени склон-
на перекрываться с ор-
биталями других атомов,
чем отдельные «чистые»
2s- и 2р-орбитали. Все че-
тыре гибридные орбита-
ли строго ориентированы
в пространстве и созда-
ют своими утолщенными
«лепестками» геометри-
ческую фигуру – тетра-
эдр, так как они располо-
жены относительно друг
друга под углом 109° 28'.
Состояние углеродного
атома с spЗ-гибридными орбиталями называют первым валентным
состоянием.
sp2-Гибридизация является результатом смешения одной 2s- и двух
2р-орбиталей. При этом образуются три гибридные орбитали, расположенные в одной
плоскости под углом 120° друг к другу (плоскость равностороннего
треугольника). Третья 2р-орбиталь, не принимающая участия в
гибридизации, сохраняет свою прежнюю форму и располагается в
плоскости, перпендикулярной плоскости гибридных орбиталей. Такое
состояние атома углерода называется вторым валентным состоянием.
sp-Гибридизация происходит при смешении одной 2s- и одной 2р-
орбитали. При этом образуются две гибридные орбитали, расположенные на одной
прямой линии. Остальные две 2р-орбитали, не участвующие в гибридиза-
ции, располагаются во взаимно перпендикулярных плоскостях. При таком ти-
пе гибридизации атом углерода находится в третьем валентном состоянии
Типы химической связи в органических соединениях
Наиболее распространенным типом химической связи в органиче-
ских соединениях является ковалентная связь. Она образуется за счет
перекрывания орбиталей двух атомов с образованием общей электрон-
ной пары. Ковалентная связь может быть простой (одинарной),
двойной и тройной.
Простая (одинарная) или σ(сигма)-связь – связь между атома-
ми, осуществляемая одной парой электронов, максимальная
плотность которых расположена на линии, соединяющей
центры этих атомов.
Такая связь может быть образована при перекрывании орбита-
лей как s-, так и 2р-электронов, а также электронов орбиталей, находя-
щихся в состоянии sp3-, sp2- и sр-гибридизации.
Кратная химическая связь – это связь, образованная обоб-
ществлением двух или трех электронных пар.
Кратная связь может быть двойной (в случае двух пар электро-
нов) или тройной (с участием трех пар электронов). Кратные связи
состоят из одной σ-связи и одной или двух π-связей. В этом слу-
чае σ-связь образуется в результате перекрывания sр2-гибридных
орбиталей, а π-связь негибридизованных 2р-орбиталей. Электроны,
принимающие участие в образовании π-связи, называют π-
электронами.
Молекула с ковалентной связью может быть неполярной, если
связанные этой связью атомы имеют одинаковую электроотрица-
тельность (например, в случае молекулы водорода). Если же один
из атомов обладает большим сродством к электрону и по этой при-
чине электронная плотность смещена в его сторону, то такая моле-
кула или связь будет полярной. Так, в формуле δ+ δ-
СН3 Сl знаки δ+ и
δ- означают, что на атоме хлора имеется избыточная электронная
плотность (частичный отрицательный заряд), а на атоме углерода – их
дефицит (частичный положительный заряд). Смещение электрон-
ной плотности можно показать стрелкой: СН3 → С1. Чем больше раз-
ница в электроотрицательности атомов, связанных ковалентной свя-
зью, тем более полярна молекула (или связь). Практически все
ковалентные связи полярны (за исключением симметричных моле-
кул).
Полярность является важной характеристикой химических свя-
зей, во многом определяя физические и химические свойства и поведение органических соединений. От наличия того или иного заряда на атоме зависит его реакционная способность.
В ряде органических соединений присутствуют семиполярные , или ковалентно-координационные связи.
Такие связи совмещают в себе свойства ковалентных и ионных связей.
Графически их обозначают стрелкой, указывающей направление сме-
щения электронов.
Водородная связь возникает между атомами, имеющими свободную
электронную пару (кислород, азот, сера и др.), и водородом, который
связан с другим атомом высокополярной ковалентной связью. В этом
случае водород обладает довольно высокой протонной подвижностью,
в результате чего возникает связь особого типа.
Водородные связи гораздо менее прочны, чем обычные ковалент-
ные; Также их влияние
сильно отражается на химических и физических свойствах веществ.
Водородная связь играет огромную роль в живой природе, в про-
цессах крашения, в приготовлении некоторых полимерных материа-
лов, во многих системах, используемых в качестве строительных рас-
творов и вяжущих материалов.
4) Молекула органического соединения пред ставляет собой совокупность атомов, связанных в определенном порядке, как правило, ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности. Величины электроотрицательностей в значительной степени определяют такие важнейшие характеристики связи, как полярность и прочность (энергия образования). В свою очередь, полярность и прочность связей в молекуле, в значительной степени, определяют возможности молекулы вступать в те или иные химические реакции. Электроотрицательность атома углерода зависит от состояния его гибридизации. Это связано с долей s-орбитали в гибридной орбитали: она меньше у sp3- и больше у sp2- и sp-гибридных атомов. Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается, в основном, через систему ковалентных связей, с помощью так называемых электронных эффектов. Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей. Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой "дельта" (). Атом, "оттягивающий" электронную плотность s-связи в свою сторону, приобретает отрицательный заряд -. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по s-связи соответственно будет иметь равный по величине дефицит электронной плотности, т.е. частичный положительный заряд +, будет называться электронодонором. Смещение электронной плотности по цепи -связей называется индуктивным эффектом и обозначается I. Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех -связей обозначается прямыми стрелками. В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей. Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода к себе, проявляют отрицательный индуктивный эффект(-I-эффект). Электродонорные заместители, т.е. атом или группа атомов, смещающие электронную плотность к атому углерода от себя, проявляют положительный индуктивный эффект (+I-эффект). +I-эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (метил, этил и т.д.). Большинство функциональных групп проявляют -I-эффект: галогены, аминогруппа, гидроксильная, карбонильная, карбоксильная группы. Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. При передаче индуктивного эффекта метальной группы на двойную связь в первую очередь ее влияние испытывает подвижная -связь. Влияние заместителя на распределение электронной плотности, передаваемое по -связям, называют мезомерным эффектом (М). Мезомерный эффект также может быть отрицательным и положительным. В структурных формулах его изображают изогнутой стрелкой, начинающейся у центра электронной плотности и завершающейся в том месте, куда смещается электронная плотность. Наличие электронных эффектов ведет к перераспределению электронной плотности в молекуле и появлению частичных зарядов на отдельных атомах. Это определяет реакционную способность молекулы.
5) стереоизомеры, которые не являются зеркальными изображениями друг друга, называются диастереомерами. В качестве примера можно привести мезо-винную кислоту и, например, (+)-винную кислоту:
цис-изомер представляет собой мезо-форму, а транс-изомер существует в виде пары энантиомеров (d,l-пара). Таким образом, эта циклическая система представляет собой пример соединения, которое может проявлять как диастереомерию (цис- и любой из транс-изомеров), так и энантиомерию (два зеркальных транс-изомера).Поскольку установлено, что диастереомеры отличаются по химическим и физическим свойствам, включая и устойчивость, можно понять, почему энантиомерные молекулы, одинаково реагирующие с симметричными реагентами, ведут себя различно по отношению к хиральным молекулам, таким, как ферменты. Если два энантиомера взаимодействуют с одними и теми же хиральными реагентами, то образующиеся активированные комплексы будут диастереомерными, а не энантиомерными и, следовательно, будут отличаться по своей энергии. Так, один энантиомер образует активированный комплекс (с меньшей энергией) быстрее, чем другой энантиомер диастереомерный активированный комплекс (с большей энергией). В качестве примера опять можно привести перчатки и руки: правая и левая перчатки одинаково укладываются в прямоугольной коробке (симметричный реагент) и совершенно различно надеваются на левую руку (хиральный реагент); в последнем случае левая перчатка образует комплекс с значительно меньшей энергией (рука в перчатке) и поэтому будет надеваться гораздо быстрее (на самом деле правую перчатку надеть на левую руку нельзя). Такая аналогия объясняет, например, почему мясомолочная кислота дегидрируется в пировиноградную кислоту под действием молочнокислой дегидрогеназы из сердца быка, а молочная кислота брожения не дегидрируется: в этом случае две молочные кислоты соответствуют двум перчаткам, а хиральный фермент – левой руке, которая принимает и делает реакционноспособным только один из энантиомеров. МЕЗА-ФОРМА |
|
6)СОПРЯЖЕНИЕ
СВЯЗЕЙ
чередование простых и кратных
связей в
структурной ф-ле соед. В широком смысле
понятие сопряжения связей охватывает
также гомосопряжение (в альтернирующую
последовательность простых и двойных
связей включается
один или большее число
sp3-гибридизованных атомов,
спиросопряжение , сверхсопряжение
(гиперконъюгация)-сопряжение кратных
(или группы простых) связей с
группой s-связей
одного атома
![]() Расширение
толкования сопряжения связей связано
также с представлениями о сопряжении
не только неск. связей, но и кратных
(или простых) связей с любым атомным
центром-как обладающим одним электроном или
неподеленной электронной парой ,
так и центром с вакантной орбиталью.
Структурная единица, содержащая
сопряженные связи, наз. сопряженной
системой.Квантовая
химия рассматривает
сопряжение связей как взаимод.
между орбиталями отдельных
фрагментов молекулы,
к-рое может осуществляться по тому или
иному механизму. Напр., s-сопряжению
соответствует взаимод. орбиталей простых
связей, p-сопряжению
- взаимод. орбиталей кратных
связей. s-Сопряжение
связей всегда присутствует в
любой молекуле,
состоящей из трех или большего
числа атомов.Сопряжение
связей не обязательно означает
неприменимость модели локализованных
связей к рассматриваемой молекуле.
В то же время в ароматич. и нек-рых др.
системах, к-рые наилучшим образом
описываются суперпозицией резонансных
структур и где доли локализованных
мол. орбиталей имеют
большие веса вне
связей, сопряжение связей обычно
отождествляется с делокализацией
связей. Экспериментально наблюдаемые
коллективные св-ва таких сопряженных
систем в принципе нельзя представить
в виде аддитивных ф-ций св-в связей.
Наиб.существенной особенностью
сопряженных систем с делокализованными
связями является их повыш. термо-динамич.
устойчивость. В ароматич. системах теплоты
образования значительно
выше, чем значения, найденные с учетом
аддитивности локальных параметров, а
связи характеризуются полной
выравненностью длин. Количеств. мера
повыш. термодинамич. устойчивости таких
систем-энергия резонанса. Наличием
сопряжения связей объясняют характерное
изменение геометрии молекулы -
укорочение формально простых и удлинение
формально кратных
связей.
Сопряженные системы с делокализованными
связями
представляют собой соед. с характсристич.
электронными переходами, причем с
удлинением цепи сопряжения повышается
интенсивность и смещается поглощение
в электронных
спектрах в
сторону больших длин волн. Понятие о
сопряжении связей используют при
рассмотрении реакц. способности. Напр.,
электроф. присоединение к сопряженным диенам
приводит
к смеси продуктов 1,2- и 1,4-присоединения.
Мезомерные
эффекты,
подобно
индуктивным, вызывают поляризацию
молекул в их основных состояниях и
поэтому сказываются на физических
свойствах соединений. Существенное
различие между индуктивными и мезомерными
эффектами состоит в том, что если
индуктивные эффекты могут действовать
как в насыщенных, так и в ненасыщенных
соединениях, то мезомер-ные эффекты
могут действовать только в ненасыщенных
и, особенно, в сопряженных соединениях.
Мезомерные
эффекты не
могут быть изолированы от индукционных
эффектов тех же заместителей, а поэтому
всегда необходимо рассматривать их
комбинированное действие. Влияние
результирующего эффекта имеет очень
большое значение не только в отношении
изменения частот поглощения в инфракрасной
области спектра, но также и вследствие
того, что от него зависят многие другие
важные физические свойства. Изменения
степени кислотности и основности,
величин дипольных моментов, длин связей
и в соответствующих случаях скоростей
реакций - все это определяется прежде
всего результирующим эффектом,
обусловленным действием индукционного
( /) и мезомерного ( М) эффектов. Мезомерные
эффекты влияют
также на силу ароматических
оснований.Мезомерные
эффекты могут
передаваться также в непредельных
системах, не содержащих углерода.Мезомерные
эффекты действуют
на фоне сильных индуктивных эффектов
галогенов. Эти ( - / ( - эффекты замедляют
реакцию и способствуют смещению
равновесия вправо. Подобно индуктивным
эффектам мезомерные
эффекты обусловливают
поляризацию молекул в основном состоянии
и поэтому отражаются на физических
свойствах соединений. Существенное
различие между индуктивным и мезомерным
эффектами заключается в том, что первые
характерны главным образом для насыщенных
групп или соединений, в то время как
вторые чаще проявляются в ненасыщенных
и особенно в сопряженных соединениях.
Как индуктивные, так и мезомерные
эффекты влияют на свойства соединений
и в статическом, и в динамическом
состояниях: они сказываются на положении
равновесия, на скорости реакций, на
силе кислот и оснований, а также на
реакционной способности соответствующих
алкилгалогенидов и на относительной
легкости замещения различных ароматических
соединений. Индуктивные
и мезомерные эффекты,
а также эффект гиперконъюгации
обусловливают снижение реакционной
способности карбонильных соединений
в приведенном выше порядке. Сверхсопряжение,
как называют этот тип взаимодействия,
не ограничено только метильной группой.
Любая группа, имеющая орбитали с
компонентами симметрии, может в принципе
продолжить область сопряжения
ненасыщенной системыме.Сверхсопряжение проявляется
в том - что атомы водорода радикала,
связанного с ненасыщенной группой,
являются активированными (
протонизированными): электронная
плотность связей С - Н смещается в
сторону двойной связи.Сверхсопряжение по
своему характеру напоминает обычное
сопряжение, но намного слабее и
проявляется в донорных свойствах
алкильной группы, если при этом
потенциальная энергия системы
уменьшается. Эффект особенно велик в
случае метильной группы и уменьшается
в ряду: первичные, вторичные и третичные
алкильные группы.
Расширение
толкования сопряжения связей связано
также с представлениями о сопряжении
не только неск. связей, но и кратных
(или простых) связей с любым атомным
центром-как обладающим одним электроном или
неподеленной электронной парой ,
так и центром с вакантной орбиталью.
Структурная единица, содержащая
сопряженные связи, наз. сопряженной
системой.Квантовая
химия рассматривает
сопряжение связей как взаимод.
между орбиталями отдельных
фрагментов молекулы,
к-рое может осуществляться по тому или
иному механизму. Напр., s-сопряжению
соответствует взаимод. орбиталей простых
связей, p-сопряжению
- взаимод. орбиталей кратных
связей. s-Сопряжение
связей всегда присутствует в
любой молекуле,
состоящей из трех или большего
числа атомов.Сопряжение
связей не обязательно означает
неприменимость модели локализованных
связей к рассматриваемой молекуле.
В то же время в ароматич. и нек-рых др.
системах, к-рые наилучшим образом
описываются суперпозицией резонансных
структур и где доли локализованных
мол. орбиталей имеют
большие веса вне
связей, сопряжение связей обычно
отождествляется с делокализацией
связей. Экспериментально наблюдаемые
коллективные св-ва таких сопряженных
систем в принципе нельзя представить
в виде аддитивных ф-ций св-в связей.
Наиб.существенной особенностью
сопряженных систем с делокализованными
связями является их повыш. термо-динамич.
устойчивость. В ароматич. системах теплоты
образования значительно
выше, чем значения, найденные с учетом
аддитивности локальных параметров, а
связи характеризуются полной
выравненностью длин. Количеств. мера
повыш. термодинамич. устойчивости таких
систем-энергия резонанса. Наличием
сопряжения связей объясняют характерное
изменение геометрии молекулы -
укорочение формально простых и удлинение
формально кратных
связей.
Сопряженные системы с делокализованными
связями
представляют собой соед. с характсристич.
электронными переходами, причем с
удлинением цепи сопряжения повышается
интенсивность и смещается поглощение
в электронных
спектрах в
сторону больших длин волн. Понятие о
сопряжении связей используют при
рассмотрении реакц. способности. Напр.,
электроф. присоединение к сопряженным диенам
приводит
к смеси продуктов 1,2- и 1,4-присоединения.
Мезомерные
эффекты,
подобно
индуктивным, вызывают поляризацию
молекул в их основных состояниях и
поэтому сказываются на физических
свойствах соединений. Существенное
различие между индуктивными и мезомерными
эффектами состоит в том, что если
индуктивные эффекты могут действовать
как в насыщенных, так и в ненасыщенных
соединениях, то мезомер-ные эффекты
могут действовать только в ненасыщенных
и, особенно, в сопряженных соединениях.
Мезомерные
эффекты не
могут быть изолированы от индукционных
эффектов тех же заместителей, а поэтому
всегда необходимо рассматривать их
комбинированное действие. Влияние
результирующего эффекта имеет очень
большое значение не только в отношении
изменения частот поглощения в инфракрасной
области спектра, но также и вследствие
того, что от него зависят многие другие
важные физические свойства. Изменения
степени кислотности и основности,
величин дипольных моментов, длин связей
и в соответствующих случаях скоростей
реакций - все это определяется прежде
всего результирующим эффектом,
обусловленным действием индукционного
( /) и мезомерного ( М) эффектов. Мезомерные
эффекты влияют
также на силу ароматических
оснований.Мезомерные
эффекты могут
передаваться также в непредельных
системах, не содержащих углерода.Мезомерные
эффекты действуют
на фоне сильных индуктивных эффектов
галогенов. Эти ( - / ( - эффекты замедляют
реакцию и способствуют смещению
равновесия вправо. Подобно индуктивным
эффектам мезомерные
эффекты обусловливают
поляризацию молекул в основном состоянии
и поэтому отражаются на физических
свойствах соединений. Существенное
различие между индуктивным и мезомерным
эффектами заключается в том, что первые
характерны главным образом для насыщенных
групп или соединений, в то время как
вторые чаще проявляются в ненасыщенных
и особенно в сопряженных соединениях.
Как индуктивные, так и мезомерные
эффекты влияют на свойства соединений
и в статическом, и в динамическом
состояниях: они сказываются на положении
равновесия, на скорости реакций, на
силе кислот и оснований, а также на
реакционной способности соответствующих
алкилгалогенидов и на относительной
легкости замещения различных ароматических
соединений. Индуктивные
и мезомерные эффекты,
а также эффект гиперконъюгации
обусловливают снижение реакционной
способности карбонильных соединений
в приведенном выше порядке. Сверхсопряжение,
как называют этот тип взаимодействия,
не ограничено только метильной группой.
Любая группа, имеющая орбитали с
компонентами симметрии, может в принципе
продолжить область сопряжения
ненасыщенной системыме.Сверхсопряжение проявляется
в том - что атомы водорода радикала,
связанного с ненасыщенной группой,
являются активированными (
протонизированными): электронная
плотность связей С - Н смещается в
сторону двойной связи.Сверхсопряжение по
своему характеру напоминает обычное
сопряжение, но намного слабее и
проявляется в донорных свойствах
алкильной группы, если при этом
потенциальная энергия системы
уменьшается. Эффект особенно велик в
случае метильной группы и уменьшается
в ряду: первичные, вторичные и третичные
алкильные группы.
7) СИММЕТРИЯ МОЛЕКУЛ, совокупность операций симметрии, применение к-рых переводит молекулу в физически тождеств. объект (саму в себя). Операциями симметрии молекул считаются преобразования пространства и времени, а также перестановки тождеств. частиц. Выполнение операций симметрии молекул оставляют без изменений ур-ния, выражающие физ. законы; иными словами, эти ур-ния инвариантны относительно операций симметрии. При последоват. выполнении неск. операций симметрии инвариантность сохраняется на каждом шаге; операции симметрииобразуют в мат. смысле группу. В частности, физ. законы должны быть сформулированы так, чтобы они отражали постулируемые на основанииопытных данных однородность и изотропность пространства и неразличимость тождеств. частиц.Хиральность -отсутствие симметрии относительно правой и левой стороны. Например, если отражение объекта в идеальном плоском зеркале отличается от самого объекта, то объекту присуща хиральность,В химии свойство молекулы быть несовместимой со своим зеркальным отражением любой комбинацией вращений и перемещений в трёхмерном пространстве.Наряду с конфигурацией и конформацией хиральность — основное понятие современной стереохимии. Хиральностью обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии Sn Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями. Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6'-динитро-2,2'-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене. Рацемат — эквимолярная смесь пары энантиомеров. Не обладает оптической активностью. Почти всегда при протекании реакций с участием хирального центра образуется именно такая смесь (исключение — стереоспецифичные и стереоселективные реакции). В некоторых случаях при кристаллизации рацемических смесей образуют кристаллическую структуру, имеющую макроскопические параметры, отличные от обоих энантиомеров. ФИШЕРА ФОРМУЛЫ (проекции Фишера), способ изображения на плоскости пространств. структур орг. соед., имеющих один или неск. хиральных центров. При проектировании молекулы на плоскости асимметрич. атом обычно опускают, сохраняя лишь перекрещивающиеся линии и символы заместителей; при этом заместители, находящиеся перед плоскостью, располагают справа и слева, а за плоскостью - вверху и внизу (пунктирная линия). Ф-лы Фишера для молекулы с одним асимметрич. атомом (I), а также схема построения такой ф-лы для соединений с двумя асимметрич.атомами (П). Цепь молекулы с неск. асимметрич. атомами располагают в пространстве вертикально в виде равномерно выпуклой ломаной линии, обращенной выпуклостью к наблюдателю. При написании Фишера формул обычно функц. группу (если она стоит в конце цепи) ставят наверху и главную цепь располагают вертикально. При повороте ф-лы в плоскости чертежа на 180°, а также в случае двух (или любого четного числа) перестановок заместителей у одного асимметрич.атома С либо при перемене местами трех заместителей по часовой или против часовой стрелки (ф-лы б, в, г) стереохим. смысл ф-лы не меняется; поворот ф-лы на 180° с выводом из плоскости, а также перемена местами двух заместителей (т.е. нечетное число перестановок) приводит к проекции антипода (а и б):
8
Явление,
когда вещество может существовать в
виде нескольких изомерных форм, легко
переходящих друг в друга и находящихся
в динамическом равновесии, называют
таутомерией.
Переходящие друг в друга формы называются
таутомерами,
а их взаимный переход - таутомерным
превращением.
Таутомерные превращения характерны
для многих классов органических
соединений.Таутомеры —
это изомеры различного строения,
находящиеся в динамическом равновесии.
Для альдегидов и кетонов характерно
явление кето-енольной таутомерии.
Таутомерные формы отличаются положением
атома водорода и для ацетона:
![]() сложный
эфир это вещество гидролизуется, как
кетон - реагирует с гидроксиламином,
фенилгидразином, синильной кислотой:
Вместе с тем ацетоуксусный эфир обладает
также свойствами, обычно не характерными
для кетонов и сложных эфиров. Он реагирует
с хлорным железом, давая красное
окрашивание, мгновенно обесцвечивает
раствор брома. Такие реакции характерны
для фенолов, спиртов, алкенов. Ацетоуксусный
эфир обладает свойствами соединений
двух классов, поскольку является смесью
кетоформы
и енольной
формы. Эти формы являются таутомерами
и существуют в равновесии друг с другом.
Кетоформа и енольная форма существуют
в состоянии динамического равновесия,
поэтому при действии, например,
гидроксиламина на эту смесь реакция
будет развиваться таким образом, что
постепенно весь ацетоуксусный эфир
перейдет в оксим.Два фактора принимают
участие в этой стабилизации: во-первых,
енол стабилизируется за счет сопряжения
двойной углерод-углеродной связи со
второй карбонильной группой и, во-вторых,
енол стабилизируется за счет
хелатообразования, то есть вследствие
образования внутримолекулярной
водородной связи между енольным
гидроксилом и второй карбонильной
группой. Переход енольной формы в
кетоформу и наоборот происходит через
карбанион, стабилизированный сопряжением.
Таутомеры различаются положением
протона и двойных связей. Такой вид
таутомерии называется прототропной
таутомерией, Содержание енольной формы
особенно велико тогда, когда она способна
стабилизироваться внутримолекулярной
водороднойНа положение равновесия
карбонильное соединение (альдегид,
кетон) - енол существенное влияние
оказывают растворители. Концентрация
енола в воде понижается в результате
образования межмолекулярных водородных
связей с карбонильной группой, что
делает эту группу менее доступной для
внутримолекулярной водородной
связи.Кето-енольное равновесие зависит
также от других факторов, например
агрегатного состояния, температуры,
пространственного положения групп.Другие
возможные или реально существующие
примеры прототропной таутомерии.
Таутомерия
фенол – кетон Для
большинства простых фенолов равновесие
смещено влево, то есть в сторону
термодинамически более стабильной
ароматической структуры. Но в некоторых
случаях содержание кетоформы значительно,
например, флороглюцин ведет себя в
отдельных реакциях, как 1,3,5-циклогексантрион
В случае равновесия между 4-пиридоном
и 4-гидроксипиридином в растворе
присутствует в основном кетоформа, а
в газовой фазе - енольная форма. Таутомерия
нитрозосоединение – оксим.
Равновесие в этой системе сильно
сдвинуто вправо. Равновесие между
алифатическими нитросоединениями и
их аци-формой.
В данном случае равновесие смещено
влево. Таутомерия
имин – енамин.
В этих случаях преобладает иминная
форма. Положение равновесия в этих
парах таутомеров зависит, кроме всего
прочего, от энергии той или иной формы.
Если энергия между различными формами
невелика (10 - 20 кДж/моль), то таутомерные
формы реально существуют в состоянии
равновесия. В рассмотренных случаях
таутомеры различаются положением
протона и двойных связей. Существуют
таутомеры, которые различаются положением
подвижных функциональных групп.
Например, в определенных условиях
способна мигрировать ацетильная или
в общем случае ацильная группа. Такой
вид таутомерии называют ацилотропией.
Еще одним видом таутомерии является
переход
от колец к линейным формам.
Такой вид таутомерии характерен для
альдегидоспиртов, в том числе для
моносахаридов. Кроме растворителей,
на положение таутомерного равновесия
оказывают влияние и другие факторы -
температура, облучение. Индуцированные
светом обратимые превращения изомеров
называют фототаутомерными. Как правило,
фототаутомеры в обычных условиях (без
облучения) находятся лишь в одной форме;
при облучении эта форма может частично
или полностью перейти в другую таутомерную
форму, которую называют фотоиндуцированной.
Обратный процесс реализуется термическим
путем, либо при облучении светом другой
длины волны, либо под действием кислот,
оснований.
сложный
эфир это вещество гидролизуется, как
кетон - реагирует с гидроксиламином,
фенилгидразином, синильной кислотой:
Вместе с тем ацетоуксусный эфир обладает
также свойствами, обычно не характерными
для кетонов и сложных эфиров. Он реагирует
с хлорным железом, давая красное
окрашивание, мгновенно обесцвечивает
раствор брома. Такие реакции характерны
для фенолов, спиртов, алкенов. Ацетоуксусный
эфир обладает свойствами соединений
двух классов, поскольку является смесью
кетоформы
и енольной
формы. Эти формы являются таутомерами
и существуют в равновесии друг с другом.
Кетоформа и енольная форма существуют
в состоянии динамического равновесия,
поэтому при действии, например,
гидроксиламина на эту смесь реакция
будет развиваться таким образом, что
постепенно весь ацетоуксусный эфир
перейдет в оксим.Два фактора принимают
участие в этой стабилизации: во-первых,
енол стабилизируется за счет сопряжения
двойной углерод-углеродной связи со
второй карбонильной группой и, во-вторых,
енол стабилизируется за счет
хелатообразования, то есть вследствие
образования внутримолекулярной
водородной связи между енольным
гидроксилом и второй карбонильной
группой. Переход енольной формы в
кетоформу и наоборот происходит через
карбанион, стабилизированный сопряжением.
Таутомеры различаются положением
протона и двойных связей. Такой вид
таутомерии называется прототропной
таутомерией, Содержание енольной формы
особенно велико тогда, когда она способна
стабилизироваться внутримолекулярной
водороднойНа положение равновесия
карбонильное соединение (альдегид,
кетон) - енол существенное влияние
оказывают растворители. Концентрация
енола в воде понижается в результате
образования межмолекулярных водородных
связей с карбонильной группой, что
делает эту группу менее доступной для
внутримолекулярной водородной
связи.Кето-енольное равновесие зависит
также от других факторов, например
агрегатного состояния, температуры,
пространственного положения групп.Другие
возможные или реально существующие
примеры прототропной таутомерии.
Таутомерия
фенол – кетон Для
большинства простых фенолов равновесие
смещено влево, то есть в сторону
термодинамически более стабильной
ароматической структуры. Но в некоторых
случаях содержание кетоформы значительно,
например, флороглюцин ведет себя в
отдельных реакциях, как 1,3,5-циклогексантрион
В случае равновесия между 4-пиридоном
и 4-гидроксипиридином в растворе
присутствует в основном кетоформа, а
в газовой фазе - енольная форма. Таутомерия
нитрозосоединение – оксим.
Равновесие в этой системе сильно
сдвинуто вправо. Равновесие между
алифатическими нитросоединениями и
их аци-формой.
В данном случае равновесие смещено
влево. Таутомерия
имин – енамин.
В этих случаях преобладает иминная
форма. Положение равновесия в этих
парах таутомеров зависит, кроме всего
прочего, от энергии той или иной формы.
Если энергия между различными формами
невелика (10 - 20 кДж/моль), то таутомерные
формы реально существуют в состоянии
равновесия. В рассмотренных случаях
таутомеры различаются положением
протона и двойных связей. Существуют
таутомеры, которые различаются положением
подвижных функциональных групп.
Например, в определенных условиях
способна мигрировать ацетильная или
в общем случае ацильная группа. Такой
вид таутомерии называют ацилотропией.
Еще одним видом таутомерии является
переход
от колец к линейным формам.
Такой вид таутомерии характерен для
альдегидоспиртов, в том числе для
моносахаридов. Кроме растворителей,
на положение таутомерного равновесия
оказывают влияние и другие факторы -
температура, облучение. Индуцированные
светом обратимые превращения изомеров
называют фототаутомерными. Как правило,
фототаутомеры в обычных условиях (без
облучения) находятся лишь в одной форме;
при облучении эта форма может частично
или полностью перейти в другую таутомерную
форму, которую называют фотоиндуцированной.
Обратный процесс реализуется термическим
путем, либо при облучении светом другой
длины волны, либо под действием кислот,
оснований.
9 Гомологический ряд и изомерия Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Гомологическая разница — —CH2—. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1…12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355.Метан CH4, Этан CH3—CH3,пропан- C3H8, Бутан-С4Н10,пентан-С5Н12,гексан-С6Н14,гептан-С7Н16, октан-С8Н18,нонан-С9Н20, декан-С10Н22. Получение:1)промышленным способом-фракционная перегонка нефти-ненфть представляет собой сложную смесь, в состав входит ок.1000 вещ.-в., большая часть –жидкие углеводороды, для разделения отдельных комнонегтов нефти ее подвергают фракционной перегонке. Каждая фракция представляет собой смесь углеводородов, кипящих в определенном интервале температур; лаборатор.способы-1)гидрирование ненасыщенных углеводородов: СН3-СН2-СН=СН2-бутен-1+Н2=СН3-СН2-СН2-СН3-н-Бутан;восстановление галогенных алканов СН3-СН2-СН2-Cl+Н2 = СН3-СН2-СН3+НCl; гидролиз магнийорганических вещ-в.СН3-СН2-Br+Mg =CH3-CH2-Mg-Br-этилмаагрийбромид; реакция вюрца CH3-Br- бромметан +2Na+Br-CH3= CH3-CH3-этан +2NaBr; разложение солей карбоновых кислот- CH3-CO ONa-ацетат натрия+NaOH = CH4-метан+Na2CO3.
10. химич.св-ва алканов Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:CH4 + Cl2 → CH3Cl + HCl (хлорметан); CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан); CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан); CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан). Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы. Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах. Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем; Нитрование:Реакция Коновалова-RH + HNO3 → RNO2 + H2O. Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов. Реакции окисления:ГорениЕ Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. CH4 + 2O2 → CO2 + 2H2O + Q. В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода). Каталитическое окисление Могут образовываться спирты, альдегиды, карбоновые кислоты. При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C) могут образоваться: метиловый спирт: 2СН4 + О2 → 2СН3ОН; формальдегид: СН4 + О2 → СН2О + Н2O; муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O. Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующиекислоты. Термические превращения алканов: Разложение Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов. CH4 → C + 2H2 (t > 1000 °C). C2H6 → 2C + 3H2. Крекинг При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой. Для метана: CH4 → С + 2H2 — при 1000 °C.Частичный крекинг: 2CH4 → C2H2 + 3H2 — при 1500 °C. Дегидрирование 1)В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода: Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3. а)CH3-CH3 → CH2=CH2 + H2 (этан → этен); б)CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен). 2)В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода: в)CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3). в')CH3-CH2-CH2-CH3 → CH2=C=CH-CH3 + 2H2 (бутан → бутадиен-1,2) 3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных: г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 3H2. Изомеризация: Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан. С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют.
11) Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:циклопропан > циклобутан >> циклопентан. Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения. Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования. Циклопропан и его производные присоединяют галогены и галогеноводороды:В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура,т.е реакция замещения. Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.


12)Молекула простейшего алкана — метана — имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах — атомы водорода. Углы между осями связей С—Н составляют 109°29
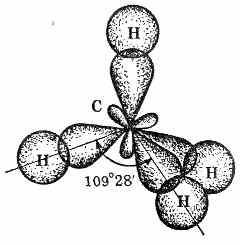 В
молекулах других предельных углеводородов
углы между связями (как С—Н, так и С—С)
имеют такое же значение. В алканах все
атомы углерода находятся в состоянии
sp3-гибридизации. Таким образом, атомы
углерода в углеродной цепи не находятся
на одной прямой. Расстояние между
соседними атомами углерода (между
ядрами атомов) строго фиксировано —
это длина химической связи (0,154 нм).
Расстояние С1 — С3, С2 — С4 и т.д. (через
один атом) тоже постоянны, т.к. постоянен
угол между связями —валентный угол.
В
молекулах других предельных углеводородов
углы между связями (как С—Н, так и С—С)
имеют такое же значение. В алканах все
атомы углерода находятся в состоянии
sp3-гибридизации. Таким образом, атомы
углерода в углеродной цепи не находятся
на одной прямой. Расстояние между
соседними атомами углерода (между
ядрами атомов) строго фиксировано —
это длина химической связи (0,154 нм).
Расстояние С1 — С3, С2 — С4 и т.д. (через
один атом) тоже постоянны, т.к. постоянен
угол между связями —валентный угол.
![]() Расстояния
между более удаленными атомами углерода
могут изменяться (в некоторых пределах)
в результате вращения вокруг -связей.
Такое вращение не нарушает перекрывания
орбиталей, образующих -связь,
поскольку эта связь имеет осевую
симметрию.Разные пространственные
формы одной молекулы, образующиеся при
вращении групп атомов вокруг -связей,
называют конформациями. Конформации
различают по энергии, но это различие
невелико (12-15 кДж/моль). Более устойчивы
такие конформации алканов, в которых
атомы расположены возможно дальше друг
от друга (отталкивание электронных
оболочек). Переход от одной конформации
к другой осуществляется за счет энергии
теплового движения. Для изображения
конформации используют специальные
пространственные формулы (формулы
Ньюмена). Разные
конформации могут превращаться друг
в друга без разрыва химических связей.
Для превращения молекулы с одной
конфигурацией в молекулу с другой
конфигурацией требуется разрыв
химических связей.
Из
четырех видов изомерии для алканов
характерны два: изомерия углеродного
скелета и оптическая изомерия “Циклические
соединения
– это такие органические соединения,в
которых углеродные атомы составляют
замкнутые цепи, т.е. циклы. Простейшими
представителями таких соединений
являются циклопарафины или
циклоалканы."Циклогексан
и его конформации "Для
циклогексана, как правильного
шестиугольника, межъядерные углы
составляют 120º. Если бы молекула
циклогексана имела плоское строение,
то отклонение от нормального валентного
угла атома углерода составляло:109,5º–120º
= 10,5º. Однако циклогексан и большие
циклы имеют неплоское строение. В
рассматриваемой молекуле циклогексана
сохраняются обычные валентные углы
при условии его существования в двух
конформациях "кресла" и "ванны".
Конформация "кресла" менее
напряжена, поэтому циклогексан существует
преимущественно в виде конформеров I и III,
причем цикл претерпевает непрерывную
инверсию с промежуточным образованием
конформера II:
Расстояния
между более удаленными атомами углерода
могут изменяться (в некоторых пределах)
в результате вращения вокруг -связей.
Такое вращение не нарушает перекрывания
орбиталей, образующих -связь,
поскольку эта связь имеет осевую
симметрию.Разные пространственные
формы одной молекулы, образующиеся при
вращении групп атомов вокруг -связей,
называют конформациями. Конформации
различают по энергии, но это различие
невелико (12-15 кДж/моль). Более устойчивы
такие конформации алканов, в которых
атомы расположены возможно дальше друг
от друга (отталкивание электронных
оболочек). Переход от одной конформации
к другой осуществляется за счет энергии
теплового движения. Для изображения
конформации используют специальные
пространственные формулы (формулы
Ньюмена). Разные
конформации могут превращаться друг
в друга без разрыва химических связей.
Для превращения молекулы с одной
конфигурацией в молекулу с другой
конфигурацией требуется разрыв
химических связей.
Из
четырех видов изомерии для алканов
характерны два: изомерия углеродного
скелета и оптическая изомерия “Циклические
соединения
– это такие органические соединения,в
которых углеродные атомы составляют
замкнутые цепи, т.е. циклы. Простейшими
представителями таких соединений
являются циклопарафины или
циклоалканы."Циклогексан
и его конформации "Для
циклогексана, как правильного
шестиугольника, межъядерные углы
составляют 120º. Если бы молекула
циклогексана имела плоское строение,
то отклонение от нормального валентного
угла атома углерода составляло:109,5º–120º
= 10,5º. Однако циклогексан и большие
циклы имеют неплоское строение. В
рассматриваемой молекуле циклогексана
сохраняются обычные валентные углы
при условии его существования в двух
конформациях "кресла" и "ванны".
Конформация "кресла" менее
напряжена, поэтому циклогексан существует
преимущественно в виде конформеров I и III,
причем цикл претерпевает непрерывную
инверсию с промежуточным образованием
конформера II:
![]() Двенадцать
связей C–H,
которые имеются у циклогексана в
конформации "кресла", делятся на
два типа. Шесть связей направлены
радиально от кольца к периферии молекулы
и называются экваториальными связями
(e- связи), остальные шесть связей
направлены параллельно друг другу и
оси симметрии и называются аксиальными
(a- связи). Три аксиальные связи направлены
в одну сторону от плоскости цикла, а
три – в другую (имеется чередование:
вверх-вниз)."
Двенадцать
связей C–H,
которые имеются у циклогексана в
конформации "кресла", делятся на
два типа. Шесть связей направлены
радиально от кольца к периферии молекулы
и называются экваториальными связями
(e- связи), остальные шесть связей
направлены параллельно друг другу и
оси симметрии и называются аксиальными
(a- связи). Три аксиальные связи направлены
в одну сторону от плоскости цикла, а
три – в другую (имеется чередование:
вверх-вниз)."


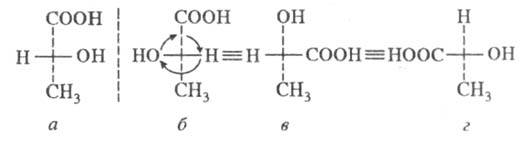
 На
рисунке фишеровские проекции винных
кислот. Первые 2 формулы представляют
собой две активные формы, (–)- и
(+)-винные кислоты, энантиомерные
по отношению друг к другу. Однако
третья и четвертая формулы представляют
собой одну и ту же молекулу, так как
одна формула может быть получена из
другой вращением на 180° в плоскости
бумаги, а такое вращение допустимо
для проекционной формулы Фишера. Они
представляют собой одну и ту же
неактивную молекулу; это следует
также из того факта, что молекула
имеет плоскость симметрии (пунктирная
линия). Таким образом, имеется винная
кислота, диастереомерная по отношению
к активным формам, но сама по себе
неактивная. Эту кислоту называют
мезовинной. Все неактивные диастереомеры
этого типа также называют “мезо-формами”.
Мезовинная кислота отличается от
каждого из активных диастереомеров
по физическим и химическим свойствам
по той же самой причине, по какой один
активный диастереомер отличается от
другого. У мезо-кислоты
меньшая плотность, она менее растворима
в воде, является более слабой кислотой,
чем активные изомеры, и имеет более
высокий дипольный момент. (–)-винная
кислота состоит из двух асимметрических
атомов углерода с одинаковым
расположением групп вокруг них.
(+)-Винная кислота также состоит из
двух асимметрических атомов углерода
с одинаковым расположением заместителей,
но противоположным расположению
для (–)-энантиомера. С другой
стороны, мезовинная кислота состоит
из двух асимметрических атомов
углерода с противоположным расположением
групп вокруг них. Этот вывод можно
сделать и из проекционной формулы,
если отделить верхнюю половину от
нижней по пунктирной линии и повернуть
ее на угол 180°.
На
рисунке фишеровские проекции винных
кислот. Первые 2 формулы представляют
собой две активные формы, (–)- и
(+)-винные кислоты, энантиомерные
по отношению друг к другу. Однако
третья и четвертая формулы представляют
собой одну и ту же молекулу, так как
одна формула может быть получена из
другой вращением на 180° в плоскости
бумаги, а такое вращение допустимо
для проекционной формулы Фишера. Они
представляют собой одну и ту же
неактивную молекулу; это следует
также из того факта, что молекула
имеет плоскость симметрии (пунктирная
линия). Таким образом, имеется винная
кислота, диастереомерная по отношению
к активным формам, но сама по себе
неактивная. Эту кислоту называют
мезовинной. Все неактивные диастереомеры
этого типа также называют “мезо-формами”.
Мезовинная кислота отличается от
каждого из активных диастереомеров
по физическим и химическим свойствам
по той же самой причине, по какой один
активный диастереомер отличается от
другого. У мезо-кислоты
меньшая плотность, она менее растворима
в воде, является более слабой кислотой,
чем активные изомеры, и имеет более
высокий дипольный момент. (–)-винная
кислота состоит из двух асимметрических
атомов углерода с одинаковым
расположением групп вокруг них.
(+)-Винная кислота также состоит из
двух асимметрических атомов углерода
с одинаковым расположением заместителей,
но противоположным расположению
для (–)-энантиомера. С другой
стороны, мезовинная кислота состоит
из двух асимметрических атомов
углерода с противоположным расположением
групп вокруг них. Этот вывод можно
сделать и из проекционной формулы,
если отделить верхнюю половину от
нижней по пунктирной линии и повернуть
ее на угол 180°.