
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
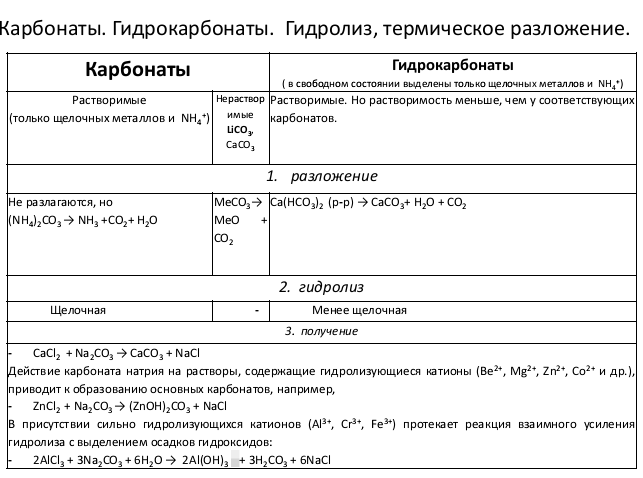
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна sp гибридиз.(2 сигмы и 2 пи связи).

Получение В промышленности
Ca2CO3 (t )= CaO + CO
В лаборатори :
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
СО2 - слабо растворим в в
CO2 + H2O =H2CO3
CO2 + NaOH = NaHCO3
CO2 + CaO = CaCO3
Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции.
![]()
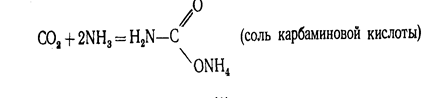
При нагревании этой соли получают ценное удобрение - карбамид СО (МН2) 2:
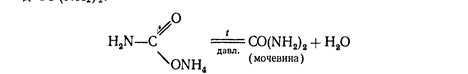
Мочевина разлагается водой
CO (NH2) 2+2HaO= (МН4) 2СОз.
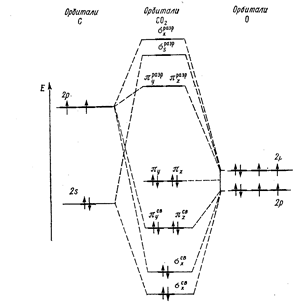
Рисунок 2. Энфгетическая диаграмма образования молекулярных орбиталей С02.
В технике оксид СО2 получают разложением карбоната кальция или гидрокарбоната натрия:
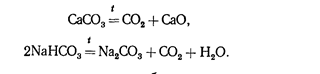
В лабораторных условиях его обычно получают по реакции (в аппарате Киппа)
СаСОз+2НС1=СаС12+С02+Н20.
Важнейшими производными С02 являются слабая угольная кислота Н2СОз и ее соли: MI2СОз и MIНСОз (карбонаты и гидрокарбонаты соответственно).
Большинство карбонатов нерастворимо в воде. Растворимые в воде карбонаты подвергаются значительному гидролизу:
![]() COз2-+H20
COз-+OH
- (I ступень).
COз2-+H20
COз-+OH
- (I ступень).
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Cr3+, ai3+, Ti4+, Zr4+ и др.
СО2 является ангидридом угольной кислотыН2СО3 и обладает всеми свойства кислотных оксидов. При растворении СО2 в воде частично образуется угольная кислота, в растворе сучествуе следующие равновесие :
Н2О + СО2=Н2СО3=(К1)катион водорода +анион НСО3=(К2) 2 катион вод +анион СО32-
Сучествование равновесия объясняется тем, что угольная кислота является очень слабоц кислотой(К1=4*10 -7, К2 =5*10-11 при 25 С)
Реакция на обнаружение СО2
Са(ОН)2+СО2= СаСО3(осд)+Н2О. Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Под действием избытка оксида углерода 4 нерастворим в Н2О карбон превращ а растворим гидрокорбанаты
СаСО3+ Н2О+СО2(изб)=Са(НСО3)2
Практически важными являются Са2СОз (сода), К2СОз (поташ) и СаСОз (мел, мрамор, известняк). Гидрокарбонаты в отличие от карбонатов растворимы в воде. Из гидрокарбонатов практическое применение находит NaHCО3 (питьевая сода).
Из солей наибольшее значение имеет сода Та2СО3 получают по аммиачному способу метод Сольвэ Важными основными карбонатами являются 2СиСОз-Си (ОН) 2, РЬСО3 Х ХРЬ (ОН) 2.
Из галогенидов углерода самое большое значение имеет-бесцветная, достаточно токсичная жидкость. В обычных условиях ССІ4химически инертен. Его применяют как невоспламеняющийся и негорючий растворитель смол, лаков, жиров, а также для получения фреона CF2CІ2 (Ткип= 303 К):
![]()
Другой используемый в практике органический растворитель - сероуглерод CSa(бесцветная, летучая жидкость с Ткип=319 К) – реакционно способное вещество:
CS2+302=C02+2S02+258 ккал/моль,
CS2+3Cl2=CCl4-S2Cl2,CS2+2H2 0==C02+2H2S, CS2+K2S=K2CS3 (соль тиоугольной кислоты Н2СSз). Пары сероуглерода ядовиты
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна sp гибридиз.(2 сигмы и 2 пи связи
Получение В промышленности
Ca2CO3 (t )= CaO + CO
В лаборатори :
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
СО2 - слабо растворим в в
CO2 + H2O =H2CO3
CO2 + NaOH = NaHCO3
CO2 + CaO = CaCO3
Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции.
При нагревании этой соли получают ценное удобрение - карбамид СО (МН2) 2:
Мочевина разлагается водой
CO (NH2) 2+2HaO= (МН4) 2СОз.



