
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
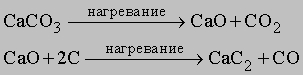
Карбиды. Углерод образует с металлами, бором и кремнием разнообразные соединения, называемые карбидами. Наиболее активные металлы (IA-IIIA подгрупп) образуют солеподобные карбиды, например Na2C2, CaC2, Mg4C3, Al4C3. В промышленности карбид кальция получают из кокса и известняка по следующим реакциям:
 <=""
div="" style="border-top-style: none;
border-right-style: none; border-bottom-style: none;
border-left-style: none; ">
Карбиды
неэлектропроводны, почти бесцветны,
гидролизуются с образованием углеводородов,
например CaC2 + 2H2O = C2H2 + Ca(OH)2 Образующийся
по реакции ацетилен C2H2 служит исходным
сырьем в производстве многих органических
веществ. Этот процесс интересен, так
как он представляет переход от сырья
неорганической природы к синтезу
органических соединений. Карбиды,
образующие при гидролизе ацетилен,
называются ацетиленидами. В карбидах
кремния и бора (SiC и B4C) связь между атомами
ковалентная. Переходные металлы (элементы
B-подгрупп) при нагревании с углеродом
тоже образуют карбиды переменного
состава в трещинах на поверхности
металла; связь в них близка к металлической.
Некоторые карбиды такого типа, например
WC, W2C, TiC и SiC, отличаются высокой твердостью
и тугоплавкостью, обладают хорошей
электропроводностью. Например, NbC, TaC и
HfC - наиболее тугоплавкие вещества (т.пл.
= 4000-4200° С), карбид диниобия Nb2C -
сверхпроводник при 9,18 К, TiC и W2C по
твердости близки алмазу, а твердость
B4C (структурного аналога алмаза) составляет
9,5 по шкале Мооса (см. рис. 2). Инертные
карбиды образуются, если радиус
переходного металла < 1,3 , а при большем
радиусе образуются реакционноспособные
карбиды типа Mn3C, Ni3C3, Fe3C.
<=""
div="" style="border-top-style: none;
border-right-style: none; border-bottom-style: none;
border-left-style: none; ">
Карбиды
неэлектропроводны, почти бесцветны,
гидролизуются с образованием углеводородов,
например CaC2 + 2H2O = C2H2 + Ca(OH)2 Образующийся
по реакции ацетилен C2H2 служит исходным
сырьем в производстве многих органических
веществ. Этот процесс интересен, так
как он представляет переход от сырья
неорганической природы к синтезу
органических соединений. Карбиды,
образующие при гидролизе ацетилен,
называются ацетиленидами. В карбидах
кремния и бора (SiC и B4C) связь между атомами
ковалентная. Переходные металлы (элементы
B-подгрупп) при нагревании с углеродом
тоже образуют карбиды переменного
состава в трещинах на поверхности
металла; связь в них близка к металлической.
Некоторые карбиды такого типа, например
WC, W2C, TiC и SiC, отличаются высокой твердостью
и тугоплавкостью, обладают хорошей
электропроводностью. Например, NbC, TaC и
HfC - наиболее тугоплавкие вещества (т.пл.
= 4000-4200° С), карбид диниобия Nb2C -
сверхпроводник при 9,18 К, TiC и W2C по
твердости близки алмазу, а твердость
B4C (структурного аналога алмаза) составляет
9,5 по шкале Мооса (см. рис. 2). Инертные
карбиды образуются, если радиус
переходного металла < 1,3 , а при большем
радиусе образуются реакционноспособные
карбиды типа Mn3C, Ni3C3, Fe3C.
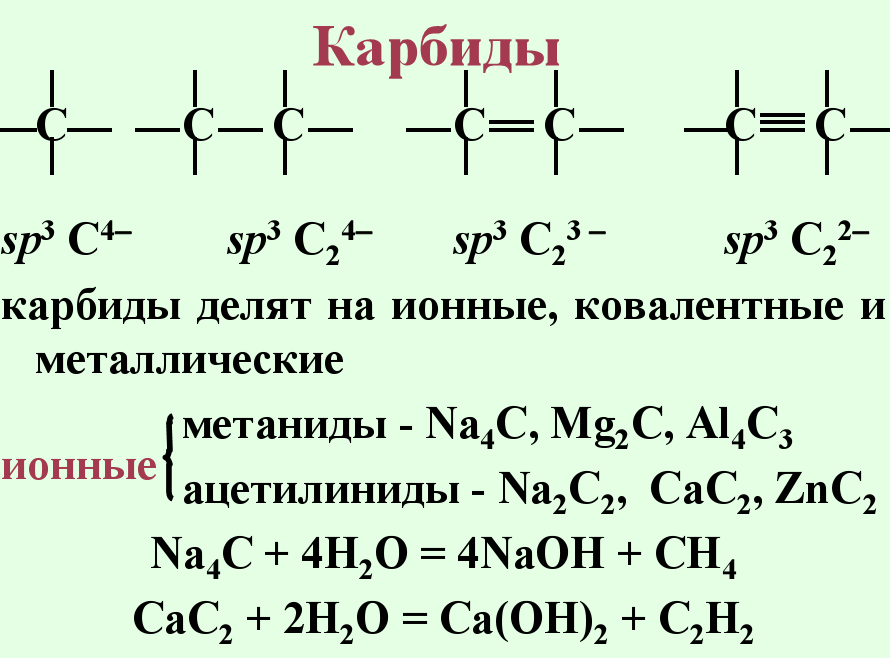
Карбиды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения где углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т.п.)
Карбиды — тугоплавкие твёрдые вещества, не растворимы[источник не указан 1313 дней] ни в одном из известных растворителей. Карбиды бора и кремния (В4С и SiC),титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью. . Карбиды-бинарные соединения углерода с более электроположительными элементам . Карбиды (по хим. Связи)Ионные (солеобразные) Li2C2 , Na2C2 , K2C2 , Cu2C2 , Ag C , MgC2 , CaC2, Al4C3 и др. Подразделяются на Метаниды(С) -4 ВеС2 И ацетилениды (С2) -2 К 2С2
металлоподобные TiC, ZrC, VC, NbC, TaC, MoC, WC, V2C, Nb2C, Ta2C, Mo2C, Mn3C, Fe3C, Co3C, Ni3C Не имеют определенного стехиометрического состава
ковалентные В12С3 ,Si C
оединения с водородом, образующие углерод. Эмпирические формулы, вид гибридизации атомов углерода, валентность и степени окисления каждого элемента.
Карбиды применяют в производстве чугунов и сталей, керамики, различных сплавов, как абразивные и шлифующие материалы, как восстановители, раскислители,катализаторы и др. WC и TiC входят в состав твердых сплавов, из которых готовят режущий инструмент; карбид кальция СаС2 используют для получения ацетилена; из карбида кремния SiC (карборунд) готовят шлифовальные круги и другие абразивы; карбид железа Fe3C (цементит) входит в состав чугунов и сталей, из карбида вольфрама и карбида хрома производят порошки, используемые при газотермическом напылении.
Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны. Металлоподобные карбиды имеют промежуточную химическую активность.
КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств. Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!, Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного. Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар. В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС=С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2. Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана. Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ. По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода. Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение. Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно). Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали. Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей. К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды. Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах.



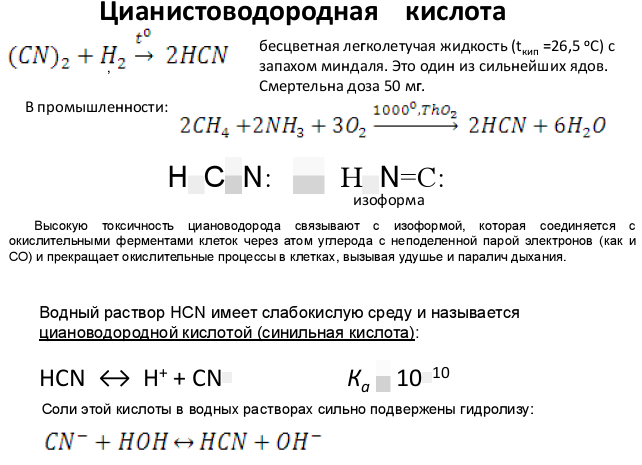
Вопрос 89 Оксид углерода(II), его КО и ОВ характеристика, свойства каклиганда, химические основы его токсичности. Цианистоводородная кислота, простые и комплексные цианиды. Химичиские основы токсичности цианидов.
Уникальной является способность оксида углерода (II) при повышенных температурах и давлениях образовывать с некоторыми металлами необычные (комплексные) соединения, называемые карбонилами: Ni+4CO=Ni(CO)4 -связях.-связях, наоборот, от металла к лиганду. В результате атом металла переходит в состояние близкое к нейтральному. Именно так ведет себя молекула СО, выполняющая роль акцептора в -связях заряд переносится от лиганда к металлу, а в

-электронов
позволяет понять особенность электронной
структуры карбонильных комплексов.
Если металл, соединяясь с лигандом,
обнаруживает невысокие значения
валентности, то в -
и При
обычных условиях жидкостями являются
карбонилы Ni(CO)4, Fe(CO)5, Ru(CO)5, Os(CO)5. Все
остальные представляют собой
кристаллические вещества. Карбонилы
металлов диамагнитны, что указывает на
наличие спаренных электронов. Все они
отличаются высокой устойчивостью по
отношению к различным химическим
реагентам. Относительная независимость
в трактовке поведения
При нагревании
карбонилы металлов разлагаются на СО
и металл, что используетсядляполучения
металлов высокой чистоты.





Токсичность цианидов определяется недиссоциированной цианистой кислотой и цианид-ионами. Цианиды — это ферментативные яды, блокирующие железосодержащий фермент — цитохромоксидазу, что приводит к нарушению тканевого дыхания и асфиксии.
Наиболее токсичны для рыб простые соединения — цианистая кислота, цианиды натрия и калия. Цианиды и аммиак, цианиды и р-крезол являются синергистами. При недостатке кислорода чувствительность рыб к цианидам резко повышается.
Токсические концентрации синильной кислоты, цианистого калия и натрия, вызывающие острое отравление, находятся в следующих пределах: для молоди форели — 0,05 — 0,09, окуней — 0,15, линей — 0,2, карасей — 0,12 — 0,31, карпов — 0,5 мг СN/л.
Комплексные цианистые соединения меди, цинка, никеля и железа сравнительно малотоксичны. Так, токсической концентрацией К3Cu(СN)4, для рыб является 1,0 мг/л и К2Zn(СN)4 — 30,0 мг/л. Желтая кровяная соль K4Fe(СN)6·ЗН2О вызывает гибель линей и карасей (за 5 дней) при концентрации 1,44 г/л, красная кровяная соль K3Fe(СN)6 — при 1,74 г/л. Ферро- и феррицианиды под действием света разрушаются с образованием свободной цианистой кислоты. При вышеуказанных концентрациях ее количество достигает 0,3 — 0,6 мг/л. Необходимо учитывать также возможность образования цианистой кислоты при диссоциации солей в кислой среде.
Цианаты и нитрилы тоже малотоксичны для рыб. Повреждающей концентрацией цианата натрия для рыб является 75 мг/л. Тиоцианат аммония токсичен для форели в концентрации 2 г/л, а тиоцианат калия для линей безвреден в количестве 640 мг/л (388 мг/л SCN).
Токсичность нитрилов — эфиров синильной кислоты следующая: токсические концентрации ацетонитрила для карпов превышают 550 мг/л, акрилнитрила — 20 — 25 мг/л.
