
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 86 Общая характеристика группы.
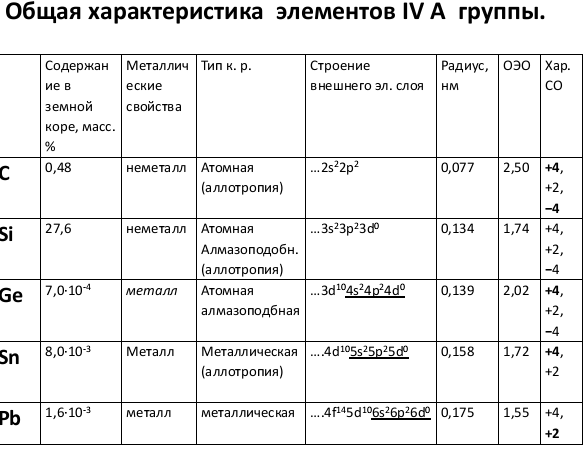
В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р-элементы IV группы периодической системы Д.И. Менделеева. Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств.
Электронное строение внешних уровней атомов первых двух элементов подгрупы можно представить так
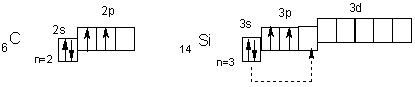
Вневозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками).
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. СО -4 в последовательности C – Pb становится все менее характерной.
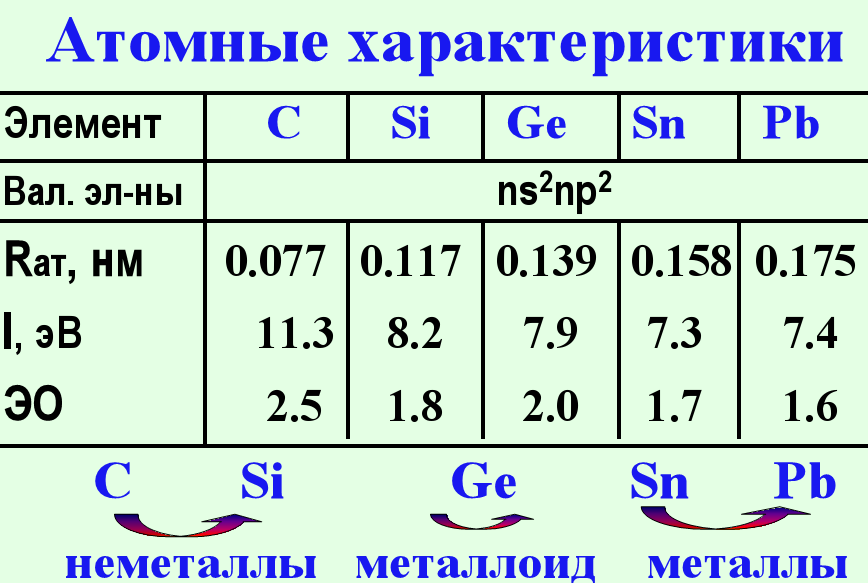
Свойства элементов подгруппы углерода
Свойства |
С |
Si |
Ge |
Sn |
Pb |
1. Порядковый номер |
6 |
14 |
32 |
50 |
82 |
2. Валентные электроны |
2s22p2 |
3s23р2 |
4s24р2 |
5s25р2 |
6s26р2 |
3. Энергия ионизации атома, эВ |
11,3 |
8,2 |
7,9 |
7,3 |
7,4 |
4. Относительная электроотрицательность |
2,50 |
1,74 |
2,02 |
1,72 |
1,55 |
5. Степень окисления в соединениях |
+4, +2, -4 |
+4, +2, -4 |
+4, -4 |
+4, +2, -4 |
+4, +2, -4 |
6. Радиус атома, нм |
0,077 |
0,134 |
0,139 |
0,158 |
0,175 |
Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения формулы RН4.Гидраты высших оксидов углерода и кремния
обладают кислотными свойствами, гидраты остальных элементов Амфотерные,
причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соеднений RН4: СН4 прочное вещество, а PbH4 в свободном виде не выделено.
В подгруппе с ростом порядкового номера уменьшается
энергия ионизации атома и увеличивается атомный радиус, т. е. неметаллические свойства ослабевают, а металлические усиливаются.
Приминение


Дополнительная информация
Химические свойства углерода и кремния. Графит и кремний — типичные восстановители . При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен) и кремний образуют диоксиды:
С + О2 = СО2,
Si + О2 = SiO2,
при недостатке кислорода можно получить монооксиды CO или SiO:
2С + О2 = 2СО,
2Si + O2 = 2SiO,
которые образуются также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО,
Si + SiO2 = 2SiO.
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя
тетрафториды СF4 и SiF4, при нагревании с хлором, давая СCl4 и SiCl4.
При более сильном нагревании углерод и кремний реагируют с серой и азотом:
4С + S8 = 4СS2,
2С + N2 = С2N2,
4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О,
3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3 + Н2↑.
Графит часто используют для восстановления малоактивных металлов из их оксидов:
СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si = Мg2Si + 2SiO.
Активные металлы — более сильные восстановители, чем углерод или кремний, поэтому последние при непосредственном взаимодействии с ними выступают в качествеокислителей
Са + 2С = СаС2,
2Mg + Si = Мg2Si.
Вопрос 87 Общая характеристика углерода. Аллотропические модификации углерода. Типы гибридизации атома углерода и строение углеродсодержащих молекул. Углерод как основа всех органических молекул. Физические и химические свойства простых веществ.
Углерод
(Carboneum), С - химический элемент IV группы,
побочной подгруппы, 2-го периода
периодической системы Д.И. Менделеева,
порядковый номер 6. Относительная атомная
масса: 12,011. Электроотрицательность:
2,6. Температура плавления: 3370єС (сгорает).
Температура кипения: 4200єС. Плотность
(графит): 2,27 г/смі. Число собственных
минералов углерода - 112; исключительно
велико число органических соединений
углерода - углеводородов и их производных.
В природе известно семь изотопов
углерода, из которых существенную роль
играют три. Два из них -
![]() и
и
![]() - являются стабильными, а один -
- являются стабильными, а один -
![]() - радиоактивным (в организме человека
его содержится около 0,1мккюри)
- радиоактивным (в организме человека
его содержится около 0,1мккюри)


Углерод- основа всех органических молекул

Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительная часть необходимой организмам энергии образуется в клетках за счёт окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Содержание углерода в живых организмах в расчёте на сухое вещество составляет: 34,5-40% у водных растений и животных, 45,4-46,5% у наземных растений и животных и 54% у бактерий Физические и химические свойства
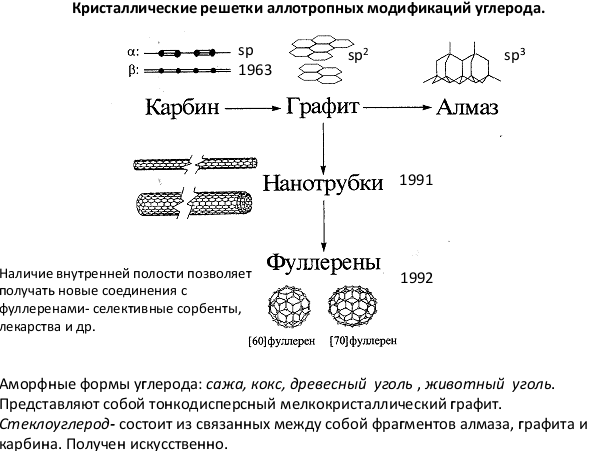
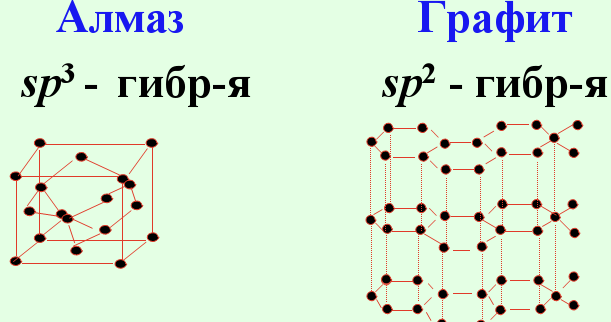
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью. Атомы расположены параллельными слоями, образуя гексагональную решетку. Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться. Сгорает при 700єС в присутствии кислорода. Встречается в природе; получается искусственно. При высокой температуре, давлении и присутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз. Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет. Не проводит электрический ток, плохо проводит тепло. В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей. Алмаз - это самое твердое вещество из всех известных. Температура плавления выше 3500єС. Химически стоек. Сгорает при 870єС в присутствии кислорода. При 1800єС в отсутствие кислорода превращается в графит. Прозрачные кристаллы; после обработки - бриллианты. Добывают из россыпей и коренных месторождений. Синтетический алмаз получают из графита при высоком давлении и температуре. Он чаще полупрозрачный или непрозрачный; имеет кристаллическую структуру и свойства природного алмаза. Жидкий углерод может быть получен при давлениях выше 10,5 Мн/мІ (105 кгс/смІ) и температурах выше 3700єС. Кокс, сажа, древесный уголь (твердый углерод) имеют то же строение, что и графит. Для твёрдого углерода характерно также состояние с неупорядоченной структурой - так называемый "аморфный" углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей "аморфного" углерода выше 1500-1600єС без доступа воздуха вызывает их превращение в графит. Физические свойства "аморфного" углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоёмкость, теплопроводность и электропроводность "аморфного" углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок чёрного цвета (плотность = 2 г/смі). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.
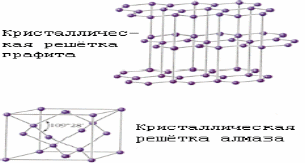
А Б
Структура алмаза (а) и графита (б).
Конфигурация внешней электронной оболочки атома углерода 2sІ2pІ. Для углерода характерно образование четырёх ковалентных связей, обусловленное возбуждением внешней электронной оболочки до состояния 2spі. Химическая связь может осуществляться за счет sp3-, sp2- и sp- гибридных орбиталей, которым соответствуют координационные числа 4, 3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода.
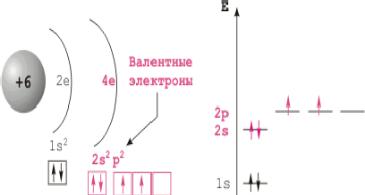
Строение атома углерода.
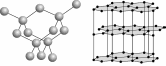
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода (углеводородов), изучаемых органической химией.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Б, ковалентные радиусы 0,77Б, 0,67Б, 0,60Б соответственно в одинарной, двойной и тройной связях; ионной радиус
С4- 2,60Б, С4+ 0,20Б. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Химическая активность убывает в ряду: "аморфный" углерод, графит, алмаз; взаимодействие с кислородом воздуха (горение) происходит соответственно при температурах выше 300-500єС, 600-700єС и 850-1000єС с образованием двуокиси углерода CO2 и окиси углерода CO.
CO2 растворяется в воде с образованием угольной кислоты. В 1906 О. Дильс получил недокись углерода C3O2. Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентрированных HNO3 и KClO3 и др.). "Аморфный" углеод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. Непосредственное соединение углерода с хлором происходит в электрической дуге; с бромом и иодом углерод не реагирует, поэтому многочисленные галогениды углерода синтезируют косвенным путём. Из оксигалогенидов общей формулы COX2 (где Х - галоген) наиболее известна хлорокись COCl2 (фосген). Водород с алмазом не взаимодействует; с графитом и "аморфным" углеродом реагирует при высоких температурах в присутствии катализаторов (никель Ni, платина Pt): при 600-1000єС образуется в основном метан CH4, при 1500-2000єС - ацетилен C2H2, в продуктах могут присутствовать также другие углеводороды, например этан C2H6, бензол C6H6. Взаимодействие серы с "аморфным" углеродом и графитом начинается при 700-800єС, с алмазом при 900-1000єС; во всех случаях образуется сероуглерод CS2. Другие соединения углерода, содержащие серу (тиоокись CS, тионедоокись C3S2, сероокись COS и тиофосген CSCl2), получают косвенным путём. При взаимодействии CS2 с сульфидами металлов образуются тиокарбонаты - соли слабой тиоугольной кислоты. Взаимодействие углерода с азотом с получением циана (CN)2 происходит при пропускании электрического разряда между угольными электродами в атмосфере азота. Среди азотсодержащих соединений углерода важное практическое значение имеют цианистый водород HCN и его многочисленные производные: цианиды, гало-генцианы, нитрилы и др. При температурах выше 1000єС углерод взаимодействует со многими металлами, давая карбиды. Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn, Cd, Cu, Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600-800°С с водяным паром и углекислым газом. Отличительной особенностью графита является способность при умеренном нагревании до 300-400єС взаимодействовать со щелочными металлами и галогенидами с образованием соединений включения типа C8Me, C24Me, C8X (где Х - галоген, Me - металл). Известны соединения включения графита с HNO3, H2SO4, FeCl3 и другие (например, бисульфат графита C24SO4H2). Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, железо Fe, никель Ni, кобальт Co).
Третья модификация - карбин- была открыта в начале 1960-х годов. Карбин представляет собой порошок глубокого черного цвета с вкраплением более крупных частиц. Электроны в атоме углерода в карбине имеют sp-гибридизацию, т.е. это цепочечный полимер, который встречается в виде двух форм.Оказалось, что карбин - самая термодинамически устойчивая форма элементарного углерода. В тех условиях, при которых графит переходит в алмаз за 30 минут, карбин не изменяется и после 15 часов выдержки.Тогда же, в начале 1960-х годов, был открыт и так называемый зеркальный углерод, имеющий, как и графит, слоистое строение, но связи между слоями здесь не слабые межмолекулярные, как в графите, а химические, более прочные. Одна из важнейших особенностей зеркального углерода (кроме твердости, стойкости к высоким температурам и т. д.) - его биологическая совместимость с живыми тканями.


.Для углерода характерты кратные связи
![]()
![]()
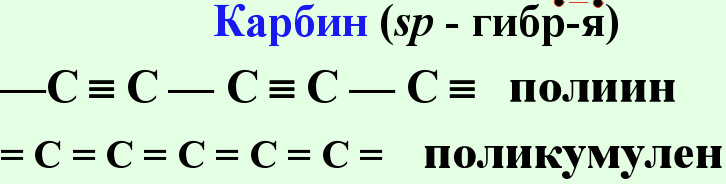
Фуллерит С 60 70, и – другие структурные организации(Смотри выше )
Углерод широко используется в виде простых веществ. Драгоценный алмаз является предметом ювелирных украшений; непрозрачный алмаз - ценный абразив, а так же материал для изготовления резцов и другого инструмента. Древесный уголь и другие аморфные формы углерода применяются для обесцвечивания, очистки, адсорбции газов, в областях техники, где требуются адсорбенты с развитой поверхностью. Графит применяют для изготовления плавильных тиглей, футеровочных плит, электродов, твердых смазочных материалов; в ракетной технике; как замедлитель нейтронов в ядерных реакторах; компонент состава для изготовления стержней для карандашей; для получения алмаза; наполнитель пластмасс. Каменноугольный кокс используется в черной металлургии в качестве топлива и восстановителя в доменных печах и вагранках. Нефтяной и электродный пековый кокс применяется для изготовления угольных и графитированных электродов, реже - как топливо. Сажа (технический углерод) применяется как наполнитель в производстве резины, пластмасс; пигмент в лакокрасочной промышленности; для изготовления электродов и т. п. Карбиды, соединения углерода с металлами, а также с бором и кремнием (например, Al4C3, SiC, B4C) отличаются высокой твердостью и используются для изготовления абразивного и режущего инструмента. Углерод применяется для получения металлов из их оксидов. Углерод входит в состав сталей и сплавов в элементном состоянии и в виде карбидов. Насыщение поверхности стальных отливок углеродом при высокой температуре (цементация) значительно увеличивает поверхностную твердость и износостойкость.
