- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
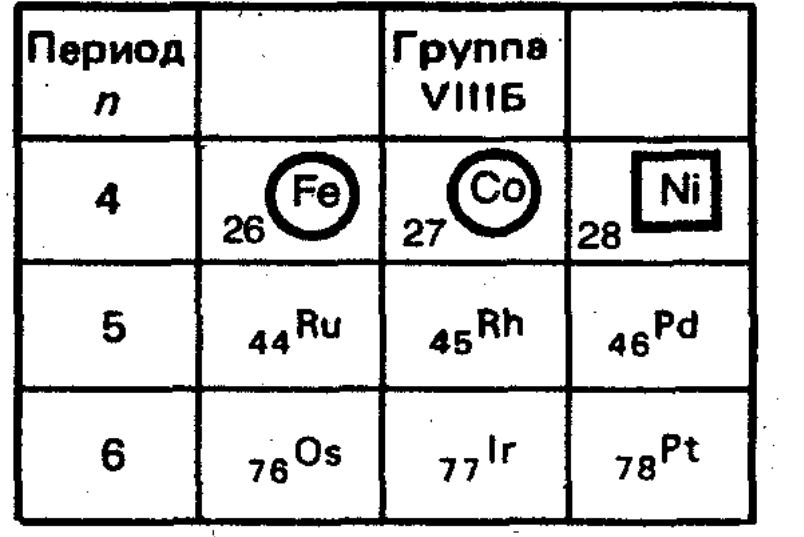
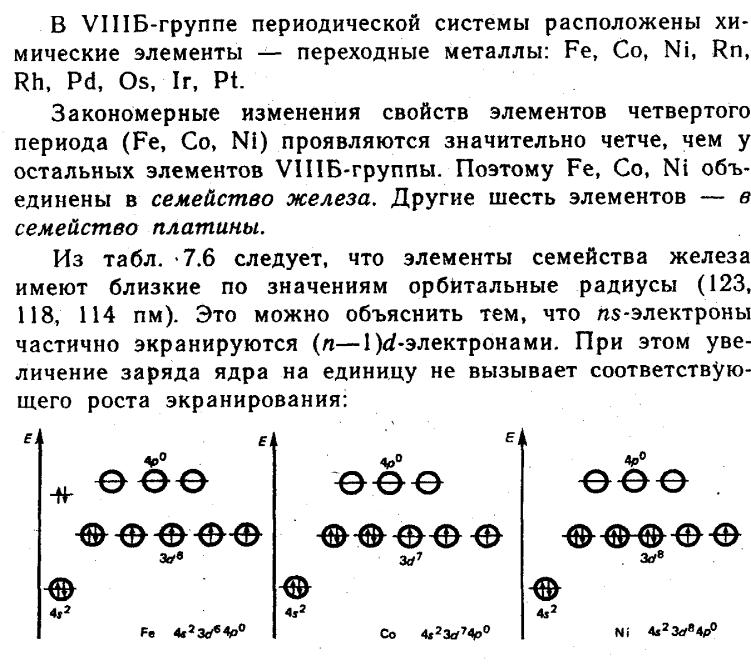
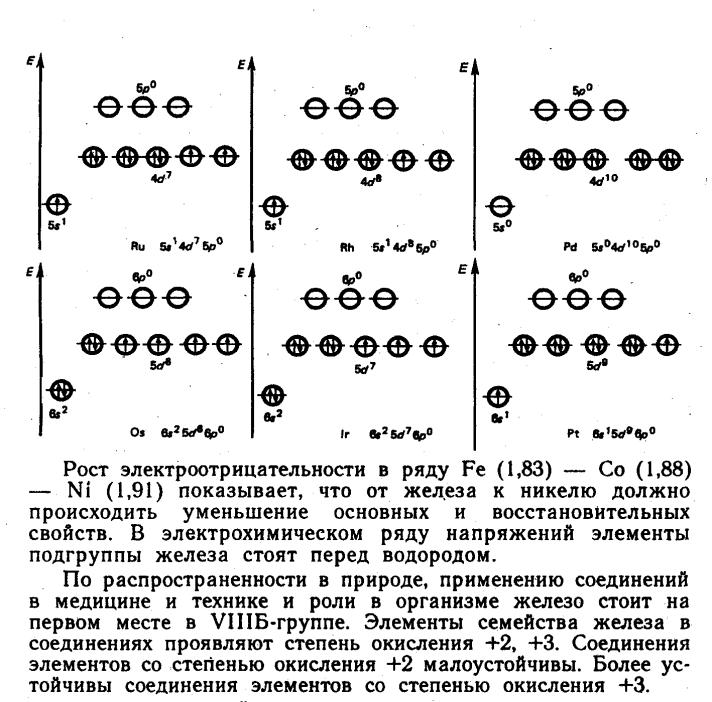
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
Соединения марганца /VI/
Оксид марганца в составе MnO3 в свободном состоянии не выделен. Отвечающий
ему гидроксид Н2MnO4 проявляет свойства кислоты /марганцовистая кислота/. Соли этой
кислоты - манганаты – получаются, как указано выше, окислением соединений марганца
/II/ или марганца /IV/ в щелочной среде.
Свободная марганцовистая кислота неустойчива. При получении ее действием
кислот на щелочные растворы манганатов она диспропорционирует в соответствии с
уравнением:
3H2MnO4=MnO2+2HMnO4+2H2O
При подкислении щелочного раствора манганата серной кислотой, суммарная реакция
выражается уравнением:
3K2MnO4 +3H2SO4=2HMnO4+MnO2+3K2SO4+2H2O
Гидролиз манганатов также сопровождается их диспропорционированием:
3K2MnO4 +2H2O= MnO2+2KMnO4+6KOH
Именно поэтому щелочные растворы магнатов при разбавлении их водой образуют
перманганаты и выпадающий в осадок диоксид марганца MnO2. Однако в сильно
щелочной среде гидролиз манганатов подавляется и здесь они довольно устойчивы.
Манганаты – сильные окислители, восстанавливающиеся в щелочной среде и
нейтральной до диоксида марганца, а в кислой – до солей марганца /II/. Однако под
действием сильных окислителей они могут быть окислены до степени окисления +7,
например:
2K2MnO4 + Br2=2KMnO4+2KBr
67 соединения марганца VII- оксид, марганцовая кислота , перманганаты ,КОи ОВ свойства , продукты восстановления перманганатов при различних значениях pH, окисление органических соединений термическое разложение. Химические основы применение калия перманганата и его раствора как антисептического средства и в фармацевтическом анализе.
Соединения марганца /VII/
Марганцовый ангидрид – Mn2O7 - темно-зеленая маслянистая жидкость, которая
образуется при действии концентрированной серной кислоты на перманганат калия.
Mn2O7 крайне неустойчив и при слабом нагревании или при ударе взрывается с
образованием оксида марганца (IV) и кислорода. Mn2O7 очень сильный окислитель.
Например, этиловый спирт и другие органические вещества при соприкосновении с ним
воспламеняются.
НMnО4 – марганцовая кислота – известна только в растворах и проявляет сильно
выраженные кислотные свойства. Как сама кислота, так и её соли – перманганаты –
принадлежат к сильным окислителям. Продукты восстановления перманганатов различны
в зависимости от реакции среды: В кислой среде восстановление идет до солей марганца
/II/ , в нейтральной и слабо щелочной – до диоксида марганца, а в сильно щелочной – до ?
манганатов:
в кислой среде: MnO4
- +5 е +8H+ =Mn2++4H2O
в нейтральной среде: MnO4
- +3 е +2Н2О=MnO2+4OH-
в щелочной среде: MnO4
- + е = MnO4
2-
9
Одна из характерных для перманганатов реакций – взаимодействие их в
нейтральном водном растворе с солями марганца /II/ в результате которого образуется
диоксид марганца (реакция сопропорционирования):
3MnSO4 +2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4
Перманганат калия термически неустойчив: при нагревании выше 2400 он
разлагается по схеме:
2KMnO4 =K2MnO4+MnO2+O2↑
Эта реакция используется для получения в лабораторных условиях кислорода.
Превращение перманганатов в манганаты с выделением кислорода может
самопроизвольно происходить и в сильно щелочных растворах, что связано с упомянутой
выше устойчивостью манганатов в щелочной среде. Это превращение выражается
следующим уравнением:
4KMnO4 +4KOH=4K2MnO4 +O2 +2H2O
Калия перманганат (калий марганцовокислый, "марганцовка"), темно-или краснофиолетовые кристаллы с металлическим блеском, растворимые в воде. Является сильным окислителем, от чего зависят его антисептические свойства. Применяют в водных растворах для полоскания рта и горла (0,020,1 %), для смазывания ожоговых и язвенных поверхностей (2-5 %), для промывания ран (0,1-0,5%), для спринцевания при гинекологических и урологических заболеваниях (0,02-0,1 %), в той же концентрации для промывания желудка при некоторых отравлениях.
68 d- ЭЛЕМЕНТЫ VIII группы .Общая характеристика группы. Деление d-элементов VIII группы на элементы семейства железа и платиновые металлы.