
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
110. Пероксид водорода h2o2
Молекула H2O2 неплоская, имеет строение H−O−O−H с σ-связью O−O на ребре и связями H-O на плоскостях двугранного угла:
молекула пероксида водорода
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу -O-O- называют пероксогруппой.
Пероксид водорода H2O2 - бесцветная жидкость, неограниченно смешивается с водой.
Физические константы:
Mr = 34,01;
ρ = 1,4 г/мл (20 °С),
tпл = −0,43 °C,
tкип = +150 °C
На свету и под действием катализаторов (MnO2) легко разлагается (при нагревании - со взрывом):
2H2O2 = 2H2O + O2↑
Известны производные H2O2:
Na2O2 - пероксид натрия
BaO2 - пероксид бария
Пероксиды при нагревании выделяют кислород:
2BaO2 = 2BaO + O2
реагируют с углекислым газом:
2Na2O2 + 2CO2 = 2 Na2CO3 + O2
(реакция используется для регенерации воздуха).
Пероксиды проявляют сильные окислительные свойства (O−I → O−II):
4H2O2 + PbS(т) = 4H2O + PbSO4↓
Na2O2(т) + 2H2SO4 + 2KI = 2H2O + I2↓ + Na2SO4 + K2SO4
и умеренные восстановительные свойства (O−I → O0):
2H2O2 + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑
5Na2O2(т) + 8H2SO4 + 2KMnO4 = 5O2↑ + 8H2O + 2MnSO4 + 5Na2SO4 + K2SO4
Получение H2O2:
BaO2 + 2HCl(конц., хол.)= BaCl2 + H2O2
Пероксиды применяются как отбеливатели текстиля, бумаги, кож, жиров и минеральных масел, окислители ракетного топлива, реагенты в органическом синтезе, при осветлении картин старых мастеров (красочный слой, потемневший из-за перехода белил (гидроксокарбоната свинца в черный PbS) осветляют переводом в белый PbSO4).
Фторид кислорода(II), дифторид кислорода, OF2. Часто используется название оксид фтора и формула F2O, что не совсем верно, так как фтор является окислителем кислорода, а не наоборот. При нормальных условиях представляет собой бесцветный газ, конденсирующийся при охлаждении в светло-жёлтую (в толстых слоях золотисто-жёлтую) жидкость. Фторид кислорода(II) имеет раздражающий запах, несколько отличающийся от запаха фтора (смесь запаха хлорной извести и озона).
Химические свойства
Дифторид кислорода — весьма энергичный окислитель, и в этом отношении напоминает по силе свободный фтор, а по механизму окислениия — озон, но реакции с участием фторида кислорода(II) требуют более высокой энергии активации, так как на первой стадии происходит образование атомарного кислорода (как и у озона). Термическое разложение фторида кислорода(II) представляет собой мономолекулярную реакцию с энергией активации 41 ккал/моль и начинается только при температуре выше 200 °C.
При растворении в горячей воде подвергается гидролизу. При этом образуется фтороводород и обычный кислород. В щелочной среде разложение протекает достаточно быстро.
Смесь паров дифторида кислорода и воды взрывоопасна:
Фторид кислорода(II) не действует на сухое стекло и кварц, но действует (интенсивно) на металлическую ртуть, что исключает применение ртути в приборах с фторидом кислорода(II). На смазку для газовых кранов фторид кислорода(II) действует очень медленно.
Кислородная терапия (греч. therapeia лечение; синоним оксигенотерапия) - применение кислорода с лечебной целью. Используется главным образом для лечения гипоксии при различных формах острой и хронической дыхательной недостаточности, реже для борьбы с раневой анаэробной инфекцией, для улучшения репаративных процессов и трофики тканей.
Физиологическое действие кислорода многостороннее, но решающее значение в лечебном эффекте имеет возмещение дефицита кислорода в тканях при гипоксии. У больных с дыхательной недостаточностью при введении кислорода повышается его напряжение в альвеолярном воздухе и в плазме крови, в связи с чем меньше становится одышка, возрастает концентрация оксигемоглобина в артериальной крови, снижается метаболический ацидоз за счет уменьшения количества недоокисленных продуктов в тканях, падает содержание катехоламинов в крови, что сопровождается нормализацией АД и деятельности сердца.
Вопрос 111. Сера - твёрдое кристаллическое вещество жёлтого цвета. Она является одним из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые "химики". Сера начала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под №16.Элемент этот был известен ещё древним египтянам. В теоретических представлениях алхимиков сера играла большую роль, так как считалась наиболее совершенным выразителем одного из "основных начал" природы - горючести. Месторождения этого жёлтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
Химические свойства Серы. Конфигурация внешних электронов атома S 3s2Зр4. В соединениях Сера проявляет степени окисления -2, +4, +6. Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов. С О2 на воздухе выше 300 °С образует оксиды: SO2 - сернистый ангидрид и SO3- серный ангидрид, из которых получают соответственно сернистую кислоту и серную кислоту, а также их соли сульфиты и сульфаты. Уже на холоду S энергично соединяется с F2, при нагревании реагирует с Cl2; с бромом Сера образует только S2Br2, иодиды серы неустойчивы. При нагревании (150-200 °С) наступает обратимая реакция с Н2 с получением сернистого водорода. Сера образует также многосернистые водороды общей формулы H2SХ, так называемые сульфаны. Известны многочисленные сераорганические соединения.
При нагревании Сера взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800-900 °С пары Серы реагируют с углеродом, образуя сероуглерод CS2. Соединения Серы с азотом (N4S4 и N2S5) могут быть получены только косвенным путем.
Гомоцепи серы имеют зигзагообразную форму, так как в их образовании принимают участие электроны, расположенные в соседних атомах на взаимно перпендикулярных р-орбиталях. Эти цепи могут достигать большой длины, или, наоборот, образовывать замкнутые кольца S20, S8, S6, S4.
Вопрос 112. На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сероводоро́д (серни́стый водоро́д, сульфид водорода, дигидросульфид) — бесцветный газ с запахом протухших яиц и сладковатым вкусом. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5 — 45 % сероводорода.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканических газов. Образуется при гниении белков. Сероводород используют в лечебных целях, например в сероводородных ваннах.[
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
![]()
Реагирует с основаниями:
![]()
![]()
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
![]()
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
![]()
(польсульфиды не нашла)
№ 115 Биологическая роль серы(сульфгидрильные группы, дисульфидные мостики в белках) Химические основы применения серы и ее соединений в медицине.
Биологическая роль серы:
сульфгидрильные группы и
дисульфидные мостики в белках
• Содержащаяся в белках сера принадлежит:
1) сульфгидрильным (-SH) группам остатков
цистеина – необходимы для проявления
биологической активности многих ферментов
2) дисульфидным мостикам (-S-S-) между
двумя остатками цистеина – играют важную
роль в поддержании третичной структуры
белков
3) тиоэфирным (-S-CH3) группам остатков
метионина – играют важную роль в
формировании гидрофобных взаимодействий
Применение серы и её
соединений в медицине и
фармации
• S – сера очищенная – противоглистное средство
• S – сера осажденная – мази и присыпки для лечения
кожных заболеваний
• MgSO4 – успокаивающее, снотворное,
противосудорожное, гипотензивное, желчегонное,
слабительное
• BaSO4 – для рентгенологического исследования ЖКТ
• Na2SO4·10H2O – глауберова соль – слабительное
средство
• CaSO4· ½H2O – медицинский гипс
Применение серы и её
соединений в фармации
• Ce(SO4)2 – количественное определение ЛС,
обладающих восстановительными
свойствами (цериметрия)
• H2SO4 – создание кислой среды
• Na2S2O3 – количественное определение йода
№116 Селен и теллур. Общая характеристика. КО и ОВ свойства водородных соединений,оксиды и кислоты(в сравнении с подобными соединениями серы) Биологическая роль селена
Общая характеристика халькогенов.
В главной подгруппе шестой группы периодической системы элементов Д. И. Менделеева находятся элементы: кислород (О), сера (S), селен (Se), теллур (Te) и полоний (Po). Эти элементы имеют общее название халькогены, что означает «образующие руды».
В подгруппе халькогенов сверху вниз с увеличением заряда атома закономерно изменяются свойства элементов: уменьшается их неметаллический характер и усиливаются металлические свойства. Так кислород ― типичный неметалл, а полоний ― металл (радиоактивен).
Сравнитель-ные характе-ристики |
16Sсера |
34Seселен |
52Teтеллур |
Электронное строение |
…3S23p4 |
…3d104S24p4 |
…4d105S25p4 |
Степень окисления |
-2, +2, +4,+6 |
-2, +2, +4 |
|
Нахождение в природе |
Самородная сера; сульфиды: свинцовый блеск PbS, медный блеск Сu2S, пирит FeS2, сероводород H2S; сульфаты: гипс CaSO4∙2H2O, горькая соль MgSO4∙7H2O, белки |
Редкий элемент, содержится в малом количестве в самородной сере, сульфидных рудах |
Редкий элемент, содержится в малом количестве в самородной сере, сульфидных рудах |
Физические свойства |
S-ромбическая ― желтые хрупкие кристаллы без запаха, не растворима в воде, ρ = 2 г/см3; S-пластическая ― коричнево-желтая, резиноподобная |
Кристаллическое вещество с металлическим блеском, ρ = 4,8 г/см3, темно-серый, полупроводник |
ρ = 6,3 г/см3, серебристо-белый, хрупкий с металлическим блеском полупроводник |
Химические свойства |
И окислительные, и восстановительные свойства |
Свойства типичного неметалла Se + O2 → SeO2 Se + Cl2 → SeCl2 Se + H2 → H2Se |
Слабо выраженные металлические свойства |
Получение |
В промышленности: из самородных руд. В лаборатории: окислением сероводорода, сульфидов |
Из отходов цветной металлургии и сернокислой промышленности, особо чистые ― дистилляцией в вакууме и зонной плавкой |
Искусственно облучением висмута в ядерных реакторах |
Применение |
Для получения серной кислоты; в сельском хозяйстве для борьбы с вредителями; производство спичек; вулканизация каучука; в производстве черного пороха. |
Производство фотоэлементов и выпрямителей электрического тока
|
В полупроводниковой технике |


Селеноводоро́д (хим. формула H2Se) — неорганическое бинарное соединение водорода и селена. Представляет собой бесцветный горючий газ с отвратительным запахом при нормальных условиях. Селеноводород — самое токсичное соединение селена с опасным периодом воздействия
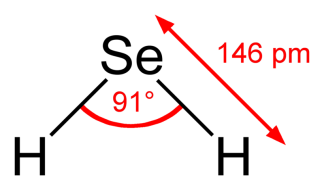
Диоксиды селена и теллура образуются при обработке простых веществ диоксидом азота, концентрированной HNO3:
Se
+ NO2
![]() SeO2
+ NO
SeO2
+ NO
![]()
Твердый диоксид селена также хорошо растворим в воде, и при этом образуется селенистая кислота SeO2 + H2O = H2SeO3. TeО2 и РоО2 в воде не растворяются в силу высокой энергии кристаллической решетки. В щелочной среде TeО2 образует теллуриты металлов
TeО2
+
2OH
![]() +
H2O.
+
H2O.
TeО2 легко растворяется в разбавленной HCl: TeO2+ 6HCl H2TeCl6 +2H2O.
SеО3
получают
дегидратацией селеновой кислоты при
150оС
с помощью фосфорного ангидрида с
последующей отгонкой SеО3
в вакууме. TeО3
синтезируют
дегидратацией ортотеллуровой кислоты
H6TeO6
при
350оС.
SеО3
и
TeО3
при нагревании легко отщепляют кислород
и образуют диоксиды. SеО3
хорошо
растворяется в воде с образованием
Н2SеО4.
Твердый SeO3
состоит из тетраэдров
![]() ,
объединенных в циклические тетрамеры
,
объединенных в циклические тетрамеры
![]() .
Твердый триоксид теллура построен из
октаэдров ТеО6,
объединенных общими вершинами в цепи.
В противоположность SО3
и SеО3,
ТеО3
водой гидратируется слабо.
.
Твердый триоксид теллура построен из
октаэдров ТеО6,
объединенных общими вершинами в цепи.
В противоположность SО3
и SеО3,
ТеО3
водой гидратируется слабо.
SеО3
обладает
сильными окислительными свойствами,
окисляя охлажденную соляную кислоту:
SеО3
+ 2HCl
![]() H2SeO3
+
H2SeO3
+
![]() Cl2,
фосфор до Р2О5.
SеО3
с органическими веществами взрывается.
Cl2,
фосфор до Р2О5.
SеО3
с органическими веществами взрывается.
Окислительные свойства триоксида теллура выражены гораздо слабее, он вытесняет хлор из соляной кислоты только при нагревании.
Биологическая роль селена
• Входит в состав белков в виде 21 аминокислоты –
селеноцистеина
• Входит в состав ряда ферментов:
глутатионпероксидаза; пероксидаза; ферменты
дейодирования тиреоидных гормонов
• Селен, входя в состав ряда ферментов,
предотвращает окисление липидов и белков
клеточных мембран, то есть, является
антиоксидантом
• Дефицит селена повышает риск возникновения с/с
патологии и онкологических заболеваний
• Соединения селена предохраняют от отравления
ртутью и кадмием (результат конкурентного
связывания с белками)
• Селен и VitE усиливают антиоксидантное действие
друг друга
№117 p-элементы 6 группы. Общая характеристика группы. Особые свойства фтора как наиболее электроотрицательного элемента. Простые вещества их хим.активность



Особые свойства
фтора,
как наиболее электроотрицательного
элемента
Фтор. Из всех галогенов
у него наименьший радиус. Относительная
электроотрицательность равна 4, это
самый электроотрицательный элемент,
во всех соединениях имеет степень
окисления – 1, остальные галогены от –
1 до + 7.
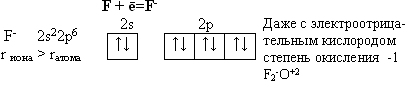 Строение
молекулы F2 по МВС
Строение
молекулы F2 по МВС
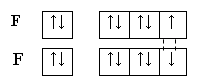
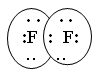 (обменный
механизм)
Строение молекулы
F2 по ММО
Исключительная
химическая активность фтора обусловлена
с одной стороны большой прочностью
образуемых им связей, так энергия связи
H - F 566кДж/моль, с другой стороны низкой
энергией связи в молекуле F2 –
151кДж/моль.
Большая энергия связей Э
– F является следствием значительной
электроотрицательности фтора и малого
размера его атома.
Низкое значение
энергии связи в молекуле F2,
объясняется сильным отталкиванием
электронных пар, находящихся на π-
орбиталях, обусловленным малой длинной
связи F – F. Благодаря малой энергии
связи молекулы фтора легко диссоциируют
на атомы и энергия активации реакций с
элементарным фтором обычно невелика,
поэтому процессы с участием F2
протекают очень быстро.
(обменный
механизм)
Строение молекулы
F2 по ММО
Исключительная
химическая активность фтора обусловлена
с одной стороны большой прочностью
образуемых им связей, так энергия связи
H - F 566кДж/моль, с другой стороны низкой
энергией связи в молекуле F2 –
151кДж/моль.
Большая энергия связей Э
– F является следствием значительной
электроотрицательности фтора и малого
размера его атома.
Низкое значение
энергии связи в молекуле F2,
объясняется сильным отталкиванием
электронных пар, находящихся на π-
орбиталях, обусловленным малой длинной
связи F – F. Благодаря малой энергии
связи молекулы фтора легко диссоциируют
на атомы и энергия активации реакций с
элементарным фтором обычно невелика,
поэтому процессы с участием F2
протекают очень быстро.
Химическая активность фтора чрезвычайно велика. Из всех элементов со фтором не образуют фторидов только три легких инертных газа — гелий, неон и аргон. Во всех соединениях фтор проявляет только одну степень окисления –1.
Со многими простыми и сложными веществами фтор реагирует напрямую. Так, при контакте с водой фтор реагирует с ней (часто говорят, что «вода горит во фторе»):
2F2+ 2H2O = 4HF + O2.
Фтор реагирует со взрывом при простом контакте с водородом:
H2 + F2 = 2HF.
При этом образуется газ фтороводород HF, неограниченно растворимый в воде с образованием сравнительно слабой плавиковой кислоты.
Фтор вступает во взаимодействие с большинством неметаллов. Так, при реакции фтора с графитом образуются соединения общей формулы CFx, при реакции фтора с кремнием — фторид SiF4, с бором — трифторид BF3. При взаимодействии фтора с серой образуются соединения SF6 и SF4 и т. д. (см. Фториды ).
Известно большое число соединений фтора с другими галогенами, например, BrF3, IF7, ClF, ClF3 и другие, причем бром и иод воспламеняются в атмосфере фтора при обычной температуре, а хлор взаимодействует с фтором при нагревании до 200-250°С.
Не реагируют со фтором непосредственно, кроме указанных инертных газов, также азот, кислород, алмаз, углекислый и угарный газы.
Вопрос № 118.
Водородные соединения галогенов ( галогеноводороды) - бесцветные газы с резким запахом, дымящие во влажном воздухе. Они хорошо растворяются в воде, водные растворы их являются кислотами, носящими общее название - галогеноводородные кислоты. Соли галогеноводородных кислот ( фториды, хлориды, бромиды и йодиды) могут быть получены при непосредственном соединении металлов с галогенами. По составу они однотипны и имеют сходные свойства. Так NaF, NaCl, NaBr, NaJ - белые кристаллические вещества, хорошо растворимые в воде. Наряду со сходством у галогенов наблюдаются и определенные различия как в физических, так и в химических свойствах. Однако изменение этих свойств происходит закономерно с возрастанием атомного веса галогена. [1]
Водородные соединения галогенов - галогеноводороды HF, НС1, НВг и HI представляют собой бесцветные газы, хорошо растворяющиеся в воде. Из них HF - слабая кислота, а остальные галогеноводороды - сильные кислоты в водном растворе. [2]
Поэтому водородные соединения галогенов более устойчивы, чем кислородные. [3]
Поэтому водородные соединения галогенов более устойчивы, чем кислородные. Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от фтора к иоду. В ряду F, С1, Вг, I наибольшим радиусом атома ( и, следовательно, наименьшим сродством к электрону) обладает иод, поэтому он характеризуется менее выраженными окислительными свойствами, чем бром, хлор и фтор. [4]
Для водородных соединений галогенов разрешено использовать следующие названия: фтороводород, хлороводород, бро-моводород и иодоводород. Названия типа хлороводородная кислота относятся к водным растворам галогеноводородов. [5] Содержание галогенов в земной коре.
Образование водородных соединений галогенов идет с большим выделением тепла, чем кислородных, поэтому водородные соединения устойчивее кислородных. Из кислородных соединений наиболее устойчивы соли кислородных кислот и наименее устойчивы оксиды. [6]
Водные растворы водородных соединений галогенов являются кислотами: HF - фтороводородная ( плавиковая), НС1 - хлороводородная ( соляная), НВг - бромоводородная, HI - иодоводород-ная. [7]
Водные растворы водородных соединений галогенов являются кислотами: HF - фтороводородная ( плавиковая), НС1 - хлороводородная ( соляная), НВг - бромводородная, HI - иодоводородная. [8]
Водные растворы водородных соединений галогенов являются кислотами: HF - фтороводородная ( плавиковая), НС1 - хлороводородная ( соляная), НВг - бромьодородная, HI - иодоводородная. [9] Какими общими свойствами обладают водородные соединения галогенов. [10]
Этим они отличаются от водородных соединений галогенов или группы кислорода. [11]
Как и в подгруппе VIA, у водородных соединений галогенов сила кислот, получающихся при растворении в воде, увеличивается по мере уменьшения электроотрицательности элемента по ряду HF, HC1, HBr, HI противопо - ложно изменению электрических моментов диполей молекул НЭ. Здесь большую роль играет значительное уменьшение прочности связи Н - Э по тому же ряду. [12]
Сжигание образца в печи; при этом образуются водородные соединения галогенов.
