
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 109. Кислород, его общая характеристика и нахождения в природе
Общая характеристика
Химический знак - O
Относительная масса - Ar(O)=16
Химическая формула O2
Относительная молекулярная масса Mr(O2)=32
В соединениях кислород обычно двухвалентен
Нахождения в природе. Кислород - самый распространенный химический элемент в земной коре. Воздух содержит 0,209 объемных долей, или 20.9% кислорода, что составляет приблизительно 1/5 по объему.
Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Получение кислорода
Получение в лаборатории. В лаборатории кислород получают при разложение некоторых сложных кислород содержащих веществ:
2H2Oпостоянный ток>2H2 + O2
2H2O2оксид магнезий>2H2O + O2
2HgO t >2Hg + O2
Молекулярный кислород. Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (~490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше, ~710 кДж/моль.)
Электронная структура. В электронной структуре молекулы кислорода не реализуется, как можно было ожидать, распределение электронов октетом вокруг каждого атома, а имеются неспаренные электроны, и кислород проявляет свойства, типичные для такого строения (например, взаимодействует с магнитным полем, являясь парамагнетиком).
Реакции. В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
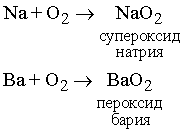
Химические свойства. Как уже упоминалось, химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2. Другие же элементы и соединения реагируют только с продуктом диссоциации O2. В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях.
Электронная структура кислорода (1s22s22p4) такова, что атом O принимает для образования устойчивой внешней электронной оболочки два электрона на внешний уровень, образуя ион O2–. В оксидах щелочных металлов образуется преимущественно ионная связь. Можно полагать, что электроны этих металлов практически целиком оттянуты к кислороду. В оксидах менее активных металлов и неметаллов переход электронов неполный, и плотность отрицательного заряда на кислороде менее выражена, поэтому связь менее ионная или более ковалентная.
При окислении металлов кислородом происходит выделение тепла, величина которого коррелирует с прочностью связи M–O. При окислении некоторых неметаллов происходит поглощение тепла, что свидетельствует об их менее прочных связях с кислородом. Такие оксиды термически неустойчивы (или менее стабильны, чем оксиды с ионной связью) и часто отличаются высокой химической активностью. В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
Озон. Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода – озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2 2O3.
При этом образуется несколько процентов озона. Реакция катализируется ионами металлов. Озон имеет острый резкий запах, который можно обнаружить вблизи работающих электрических машин или в окрестности атмосферного электрического разряда. Газ имеет голубоватый цвет и конденсируется при –112° С в темноголубую жидкость, а при –193° С образуется темнопурпуровая твердая фаза. Жидкий озон слаборастворим в жидком кислороде, а в 100 г воды при 0° С растворяется 49 см3 O3. По химическим свойствам озон намного активнее кислорода и по окислительным свойствам уступает только O, F2 и OF2 (дифториду кислорода). При обычном окислении образуются оксид и молекулярный кислород O2. При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
Классификация
В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Химические свойства
Основные оксиды
1. Основный оксид + cильная кислота → соль + вода
2. Сильноосновный оксид + вода → щелочь
3. Сильноосновный оксид + кислотный оксид → соль
4. Основный оксид + водород → металл + вода
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + основание → соль + вода
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
(в водном растворе)
(при сплавлении)
