
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
Действием на них разбавленных кислот могут быть получены аналогичные аммиаку и фосфину мышьяковистый («арсин»), сурьмянистый («стибин») и висмутистый («висмутин») водороды общей формулы ЭН3 . Реакции идут по схеме:
Mg3 Э2 + 6HCl = 3MgCl2 + 2ЭH3
Так как соединения эти малоустойчивы, больший или меньший распад их на элементы имеет место уже в момент образования и поэтому практически они всегда выделяются в смеси с водородом. Особенно это относится к BiH3 , который из–за своей чрезвычайной неустойчивости до сих пор почти не изучен.
Арсин и стибин представляют собой бесцветные, очень ядовитые газы с чесночным (AsH3 ) или похожим на сероводородный (SbH3 ) запахом. Их точки плавления и кипения сопоставлены ниже с соответствующими данными для аммиака и фосфина:
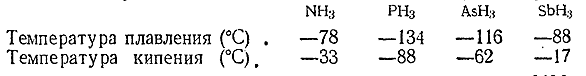
Восстановительная активность гидридов в ряду NH3 – РН3 – AsH3 –SbH3 последовательно возрастает. Столь характерные для аммиакареакции присоединения вовсе не наблюдаются у арсина и стибина. Оба они довольно хорошо растворимы в воде, но химически с ней не взаимодействуют. При нагревании AsH3 и SbH3 легко разлагаются на элементы, а будучи подожжены на воздухе, сгорают с образованием воды и соответствующих окисей.
3) Помимо разложения арсенидов и антимонидов кислотами, арсин и стибин могут быть получены также действием водорода в момент выделения на самые разнообразные растворимые соединения мышьяка и сурьмы, например по реакции
As2 O3 + 6Zn+12HCl = 6ZnCl2 + 2AsH3 + 3H2 O
На такой реакции, в сочетании с термическим разложением АsН3 , основан один из методов открытия мышьяка.
Водородные соединения Аммиак NH3, фосфин PH3, арсин AsH3, стибин SbH3. Молекулы водородных соединений имеют форму пирамиды. Связь Э – Н более прочная, чем в водородных соединениях элементов 6 и 7 групп, поэтому в водных растворах ионы водорода не образуются. При комнатной температуре – газы. Устойчивость их невысока: уже при небольшом нагревании разлагаются (кроме NH3). Прочность водородных соединений уменьшается с возрастанием порядкового номера элемента. Восстановители. Восстановительные свойства усиливаются вниз по подгруппе. Фосфин, и особенно аммиак, образуют сложные катионы – фосфоний PH4+ и аммоний NH4+.
Марша Метод
(J. Marsh, 1794-1846, англ. химик; син. Марша-Либиха-Берцелиуса метод) метод обнаружения мышьяка, основанный на его восстановлении свободным водородом до мышьяковистого водорода, наличие которого устанавливается качественными реакциями; применяется в судебной медицине.
ОБНАРУЖЕНИЕ МЫШЬЯКА В РАСТВОРАХ
Образование зеркала металлического мышьяка
Одним из давно известных и наиболее чувствительных методов обнаружения мышьяка мокрым путем является метод Марша, называемый иногда методом Марша — Либиха [976]. Метод основан на восстановлении мышьяка до арсина, последующем его термическом разложении на водород и мышьяк и выделении мышьяка на относительно холодной поверхности в виде металлического зеркала.
Определение проводят в приборе, состоящем из небольшой колби или пробирки емкостью 15—20 мл, плотно закрываемой резиновой пробкой со вставленной в нее газоотводной трубкой, наружный конец которой изогнут цод прямым углом и соединен с трубкой, заполненной безводным хлоридом
кальция (для высушивания газов, выделяющихся в процессе реакции), и далее — с трубкой из тугоплавкого стекла, заканчивающейся сужением (диаметр отверстия 1—2 мм). В колбу (пробирку) вводят анализируемый раствор, прибавляют серную кислоту (1 : 1) в таком количестве, чтобы ее концентрация в растворе была 1 М. Общий объем раствора должен составлять примерно 30—40% объема реакционного сосуда (5—20 мл). Затем в колбу (пробирку) вносят несколько гранул цинка, закрывают ее резиновой пробкой с вставленной в нее газоотводной трубкой, колбу тщательно обвертывают полотенцем (для предупреждения ранения аналитика осколками стекла в случае разрыва колбы или пробирки, при зажигании выходящей из газоотводной трубки газовой смеси). После этого выжидают некоторое время (10—20 мин. в зависимости от объема колбы или пробирки и объема содержащегося в ней раствора) для того, чтобы выделяющийся водород вытеснил воздух из прибора, а затем зажигают выходящую из трубки газовую смесь. Если ее зажечь, не дождавшись удаления всего воздуха, то произойдет взрыв содержащегося в приборе гремучего газа. В образовавшееся пламя вносят фарфоровую чашку с холодиoii водой. В присутствии мышьяка на'белой поверхности чашки образуется зеркало металлического мышьяка.
Так как металлическое зеркало образует не только мышьяк, но и сурьма, то для отличия мышьяка от сурьмы образовавшееся металлическое зеркало смачивают щелочным раствором гипохло-рита натрия, если при этом зеркало исчезает, то оно состояло из мышьяка, который растворился в щелочном растворе гипо-хлорита натрия с образованием мышьяковой кислоты; зеркало сурьмы при этом не изменяется.
Если содержание мышьяка в анализируемом растворе очень мало, то реакцию следует проводить в том же приборе, но с той разницей, что на газоотводной трубке из тугоплавкого стекла делают сужение, находящееся на расстоянии 3—5 см от конца. Перед этим сужением (на расстоянии 2—3 см) нагревают трубку газовой горелкой. Арсин, проходящий через нагретую часть трубки, разлагается; на водород и мышьяк, оседающий в суженном месте трубки в виде блестящего темного налета металлического мышьяка. Сурьма образует подобный налет (несколько более матовый), но он появляется ближе к нагреваемому месту, а иногда и впереди его.
При одновременном присутствии мышьяка и сурьмы реакция Марша становится ненадежной. В этом случае восстановление мышьяка до арсина следует проводить в щелочной среде с применением алюминиевого порошка или цинковой пыли (последнюю лучше применять в виде таблеток). Восстановление можно проводить в кислой среде, если в качестве восстановителя использовать металлическое олово. Таким путем мышьяк восстанавливается до арсина, в то время как сурьма — только до металла.
Реакция Марша чрезвычайно чувствительна и позволяет обнаруживать до 1 мкг As. Вследствие этого она часто используется в криминалистическом анализе.
Вопрос 106 Соединения мышьяка, сурьмы и висмута в положительных степенях окисления. Галиды и изменение их свойств в группе (азот - висмут). Оксиды и гидроксиды Э(III) и Э(V); их КО и ОВ характеристики. Арсениты и арсенаты, их КО и ОВ свойства. Соли катионов сурьмы(III) и висмута(III), их гидролиз. Сурьмяная кислота и ее соли. Висмутаты. Неустойчивость соединений висмута(V).
Сурьма (III) оксид Sb2О3 в воде нерастворим.
Амфотерен.
Sb2О3+ 3H2SO4 →Sb2(SO4)3 + 3H2O
Sb2О3 + 2КОН+ 3Н2О→2К[Sb(OH)4]
При гидролизе соединений сурьмы (III) образуется неустойчивый катион Sb(OH)2
+ , отщепляющий воду с образованием катиона SbO+ (стибил, антимонил):
Sb3+ + 2H2O↔Sb(OH)2
+ + 2H+ Sb(OH)2 + →SbO+ + H2O Sb2О3 ∙n H2O.
Висмут (III) оксид Bi2О3 в воде нерастворим. Bi2О3 имеет основной характер. Соответствующий ему гидроксид Bi(ОН)3, получаемый косвенно, является слабым основанием. Соли висмута (III) в растворе сильно гидролизованы с образованием катиона
висмутилаBiО+:
Bi3++ H2O↔BiО+ + 2H+ Bi2О3 входит в состав препарата ксероформ. Применяют наружно как
вяжущее средство, подсушивающее и антисептическое средство. Препарат висмута нитратосновнойсостоит из смеси продуктов гидролиза Bi(NО3)3: Bi(OH)2NО3, BiONО3 и дегидратированного висмута гидроксида BiООН. Препарат применяют в качестве вяжущего и антисептического средства при желудочно- кишечных заболеваниях. Оксиды Sb2О5 иBi2О5 в воде не растворяются.
Соли гипотетической висмутовой кислоты – висмутаты, например висмутат натрия NaBiO3, получают косвенно путем окисления соединений висмута (III)
.АРСЕНАТЫ (от лат. arsenicum - мышьяк), соли кислородсодержащих к-тAs. Различают A.(V) и арсенаты(Ш) (устаревшее назв. - арсениты). Известны арсенаты, в которых одновременно присутствуют As(III) и As(V), например Cr2As As3O12.
A.(V) и арсенаты(III)-производные соответствующих орто-мышъяковых (H3AsO4 и H3AsO3), метамышъяковых (HAsO3 и HAsO2) и полимышьяковых (напр., H4As2O7 и H4As2O5, H5As3O10, H2As4O7) к-т; в своб. виде из указанных кислот получена только H3AsO4. Наиб. распространены орто-арсенаты(V) и метаарсенаты(Ш), часто называемые просто арсенаты В основе структуры A.(V) лежат тетраэдры AsO4, причем ортоарсенаты обычно построены из изолиров. тетраэдров, а метаарсенаты имеют цепочечную или циклич. структуру (кольца из 3 или 4 тетраэдров, соединенных вершинами). В основе структуры арсенаты(Ш) лежат сплюснутые пирамиды AsO3, которые могут соединяться в цепи через атомы О.
Гидро- и дигидроортоарсенаты(V) при нагр. отщепляют воду и превращ. соотв. в пиро- и метаарсенаты(V). В кач-вепромежут. продуктов м. б. получены и др. соединения, например: NaH2AsO4 Na2H2As2O7 -> Na3H2As3O10 NaAsO3. При гидролизе мета- и пироарсенатов(V) образуются гидроарсенаты(V). При высоких температурах (около или выше температуры плавления) метаарсенаты(V) разлагаются до пироарсенатов(V), которые далее могут переходить в ортоарсенаты(V), обладающие наиб.термич. устойчивостью. При термич. разложении последних могут образовываться оксоарсенаты(V). Безводные арсенаты(Ш) при 300-550°Сдиспропорционируют с образованием A.(V) и As. Метаарсенаты(Ш) могут предварительно разлагаться до пиро- или ортоарсенатов(Ш) с отщеплением As2O3.
арсенаты щелочных металлов. а также гидроарсенаты(V) щел.-зем. и некоторых тяжелых металлов раств. в воде, арсенаты(Ш) щел.-зем. металлов малорастворимы, все остальные арсенаты практически не раств. в воде. арсенаты разлагаются минер, кислотами и растворами щелочей. арсенаты(Ш) в щелочных растворах - сильные восстановители.
арсенаты известны для всех металлов, кроме Аи и металлов платиновой группы. Щелочные металлы образуют безводные мета-, пиро- и ортоарсенаты(V), плавящиеся конгруэнтно, и триарсенаты, плавящиеся инконгруэнтно. Щел.-зем. и др. металлы в степени окисления + 2 в отсутствие воды образуют мета-, пиро- и ортоарсенаты(V), а также оксоарсенаты(V), например состава 6MO*As2O5. Изарсенаты(III) чаще других встречаются MII(AsO2)2 и MII3(AsO3)2.
Для элементов в степени окисления + 3 характерно образование ортоарсенатов(V).арсенаты(III), выделенные из водных растворов, обычно имеют состав M(AsO2)3*nН2О, полученные в отсутствие воды - МАsО3. Для элементов в степени окисления + 4 характерны гидроарсенаты(V) и пироарсенаты(V). Примеры A.(V) металлов в степени окисления + 5: NbOAsO4*4H2O и NbO(HAsO4)3 *5H2O.
Существуют двойные арсенаты, например М М AsO4, MIMIII (AsO4)2. Из арсенаты, содержащих др. анионы.наиб. изучены M5II(AsO4)3X, где Х-ОH-, F-, Сl- и др. Известно ок. 85 прир. минералов. относящихся к A.(V): скородит FeAsO4*2H2O, эритрин Co3(AsO4)2*8Н2О, оли-венит Cu2AsO4(OH), миметизитPbs(AsO4)3Cl и др. Природные арсенаты(III) - очень редкие минералы, например армангит Mn3(AsO3)2.
арсенаты получают в осн. взаимод. оксидов As или растворов мышьяковых кислот с оксидами, гидроксидами или карбонатами металлов, арсенаты тяжелых металлов - реакцией их солей с Na3AsO4 или NaAsO2 (иногда с Li3AsO4 или LiAsO2) в растворе. A.(V) синтезируют также окислением арсенаты(III).
арсенаты-диэлектрики или полупроводники с большой шириной запрещенной зоны. Многие, например KH2AsO4 или арсенаты РЗЭ,-сегнето- и пьезоэлектрики. Некоторые арсенаты-антиферромагнетики. Среди арсенаты есть и твердые электролиты.например Ag7I4AsO4, NaZr2(AsO4)3.
Гидроарсенат(V) натрия Na2HASO4*7Н2О-бесцв. кристаллы; т. пл. 57°С (см также табл.); раств. в воде, спирте и глицерине, не раств. в эфире. Получают нагреванием смеси As2O3 с NaNO3 с послед.гидролизом и перекристаллизацией из водного р-ра или окислением раствора NaAsO2 кислородом воздуха в присутствии CuSO4 либо анодным окислением. Инсектицид, антисептическое средство.
Дигидроарсенат(V) калия К.Н2АsО4 - бесцв. кристаллы.решетка тетрагональная (а = 0,76290 нм, с = = 0,71612 нм, z = 4, пространств, группы I42d); не раств. в спирте, раств. в воде и глицерине. Это соединение, как и арсенаты аммония, Rb, Cs, - материал нелинейной оптики.
СВОЙСТВА АРСЕНАТОВ
* Т-ра плавления безводной соли.
Гидроарсенат(V) свинца PbHAsO4 - белые кристаллы. Подобно арсенатам Са, Zn, Cu, Mg- инсектицид и фунгицид, антисептич. ср-во для пропитки древесины, компонент необрастающих красок для судов.
Арсенат(V) кобальта Co3(AsO4)2*8H2O - розовые кристаллы. Пигмент для росписи на стекле и фарфоре, компонент шихты в произ-ве цветного стекларсенаты
Арсенат(Ш) кальция. Техн. продукт - смесь метаарсената(Ш) Ca(AsO2)2 с ортоарсенатом(Ш) Ca3(AsO3)2. Получают взаимод. As2O3 с Са(ОН)2 при нагревании. Инсектицид, бактерицидное ср-во, компонент смеси для протравливания семян, необрастающих красок для судов.
Гидроксоарсенат(Ш) меди (зелень Шееле) Cu3(AsO3)2*nCu(OH)2*mН2О (где и = 1 - 3) - желтовато-зеленое или темно-зеленое твердое вещество; не раств. в воде и спирте. Получают взаимод. CuSO4, As2O3 и Na2CO3 в водном растворе. Арсенат(Ш)-ацетат меди (парижская, или швейнфуртская, зелень) Cu4(AsO2)6(CH3CO2)2 - изумрудно-зеленое твердое вещество; плотн. ~ 3,2 г/см3; не раств. в воде и спирте, водой постепенно гидролизуется с отщеплением As2O3. Получают взаимод. растворов CuSO4, CH3CO2Na и NaAsO2 или действием СН3СО2Н и As2O3 на Сu2(ОН)2СО3 при нагревании. Оба соед. - инсектициды и фунгициды, компоненты необрастающих красок для судов, пигменты для художеств.красок. арсенаты, в особенности водорастворимые, - сильные яды.
Не полностью
