
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
. ФОСФИДЫ, соединения фосфора с более электроположит. элементами. По типу хим. связи фосфиды подразделяют на две группы:
1. К ионным относятся фосфиды щелочных и щел.-зем. элементов и металлов подгруппы цинка. Эти фосфиды легко гидролизуются водой.хорошо раств. в кислотах с выделением PH3, сгорают в токе O2 с образованием оксидов металлов и P, реагируют с галогенами. Некоторые из них обладают полупроводниковыми свойствами из-за того, что в межатомной связи присутствует определенная доля ковалентной составляющей. ионные фосфиды - фосфиды щелочных и щелочноземельных металлов - легко гидролизуются, например:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
2Металлоподобные фосфиды образуют главным образом переходные металлы, в т. ч. РЗЭ. Их состав, как правило, не соответствует валентностям образующих их элементов. Эти фосфиды тугоплавки, устойчивы к действию воды и K-T. Их хим. стойкость растет с увеличением содержания P. Так, Ni3P, Cr3P, Fe3P, Ti3P легко разлагаются кислотами-окислителями (H2SO4, HNO3, HClO4), а также щелочами. В то же время фосфиды состава TiP, VP, TaP, CrP, FeP, MnP не взаимод. с конц. соляной кислотой и кислотами-окислителями. Они раств. при нагр. в царской водке. Все металлоподобные фосфиды разлагаются смесью HF и HNO3 и при сплав-лениис щелочами и пероксидами металлов. Многие из них -полупроводники благодаря тому, что в хим. связь вносит определенный вклад ковалентная составляющая.
3 Ковалеитные фосфиды образуются непереходными элементами III и IV гр. периодич. системы (кроме Tl). Они тугоплавки, их хим. стойкость к воде и др. агрессивным средам сильно зависит от чистоты образца. Особенно устойчивы высоко чистые вещества. Все твердые ковалентные фосфиды- полупроводники, ширина запрещенной зоны которых тем больше, чем выше доля ионной связи в них. Типичные полупроводниковые фосфиды этой группы представляют собой координац. соед., в которых помимо простых ковалентных связей присутствуют донор-но-акцепторные связи. При этом атом P - донор, а атомы более электроположит. элемента - акцепторы электронной пары.
фосфиды полуметаллов и неметаллов также главным образом ковалентные соед. Они м. б. газами (напр., PH3), твердыми веществами; по электрофиз. свойствам - диэлектриками или полупроводниками. Типичный диэлектрик - BP. Он устойчив к действию кислот-окислителей и щелочей. Другие фосфиды этой группы, например AlP и SiP, не обладают большой стойкостью к действию хим. реагентов. ковалентные фосфиды - фосфиды переходных металлов - не гидролизуются, не растворяются в воде, устойчивы к действию минеральных кислот. Обладают высокими температурами плавления (>2000oС), проявляют свойства полупроводников.
Соединения фосфора с водородом
Фосфи́н(фосфористый водород, гидрид фосфора, по номенклатуре IUPAC — фосфан РН3) — бесцветный, очень ядовитый, довольно неустойчивый газ (при нормальных условиях) со специфическим запахом гнилой рыбы.
Физические свойства
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Токсичность Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу.

Степень окисления -3. Этой степени окисления соответствует фосфин PH3 – очень ядовитый бесцветный газ с запахом тухлой рыбы. Фосфин плохо растворим в воде, PH3 значительно более слабое основание, чем аммиак, с сильными кислотами (например HClO4, HI) образует соли фосфония:
РH3 + HClO4 = PH4ClO4
Соли фосфония разлагаются водой:
PH4ClO4 = PH3 + HClO4
Фосфин легко окисляется, на воздухе сгорает с образованием белого дыма:
2PH3 + 4O2 = P2O5 + 3H2O
При наличии в фосфине примесей дифосфина P2H4 - аналога гидразина - РН3 самовоспламеняется на воздухе.
Фосфин можно получить:
а) гидролизом ионных фосфидов:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
б) кипячением белого фосфора с раствором щелочи:
P4 + 3KOH + 3H2O = 3KH2PO2 + PH3
Вопрос 103 Соединения фосфора в положительных степенях окисления. Галиды, их гидролиз. Оксиды: стереохимия и природа связи, взаимодействие с водой и спиртами. Фосфорноватистая (гипофосфористая) и фосфористая кислоты, строение молекул, КО и ОВ свойства. Дифосфорная (пирофосфорная) кислота. Изополи- и гетерополифосфорные кислоты. Метафосфорные кислоты, сравнение с азотной кислотой. Производные фосфорной кислоты в живых организмах.
Степень окисления +1. Известна фосфорноватистая кислота Н3РО2 и ее соли - гипохлориты.
Фосфорноватистая кислота - слабая одноосновная кислота:
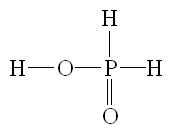
Фосфорноватистая кислота и ее соли - сильные восстановители, например:
NiCl2+NaH2PO2+2H2O=Ni + H3PO4+ NaCl + HCl+H2
получить фосфорноватистую кислоту можно, вытесняя ее из солей - гипофосфитов - серной кислотой:
NaH2PO2 + H2SO4 = NaHSO4 + H3PO2
или окислением фосфина иодом в водном растворе:
PH3+ 2I2 + 2H2O = H3PO2 + 4HI
Степень окисления +3: оксид фосфора (3) P2O3, фосфористая кислота Н3РО3 и ее соли - фосфиты.
Оксид фосфора (3) - кислотный оксид, при взаимодействии с холодной водой образует фосфористую кислоту:
P2O3 + 3H2O = 2H3PO3
Фосфористая кислота - двухосновная:
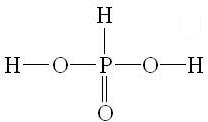
H3PO3 и ее соли - сильные восстановители:
HgCl2+ H3PO3 + H2O = H3PO4 + Hg + 2HCl
Получают Р2О3 окислением фосфора недостатком кислорода:
4P + 3O2 = 2P2O3
Фосфористую кислоту можно получить гидролизом PCl3:
PCl3 + 3H2O = H3PO3 + 3HCl
Степень окисления +5: оксид фосфора (5) P2O5, фосфорные кислоты и их соли - фосфаты.

Р2О5 (или Р4О10) - фосфорный ангидрид - белое снегообразное вещество, жадно поглощает влагу: P2O5 + H2O = 2HPO3
P2O5 - сильнейший осушитель. Степени окисления фосфора +5 соответствует несколько кислот:

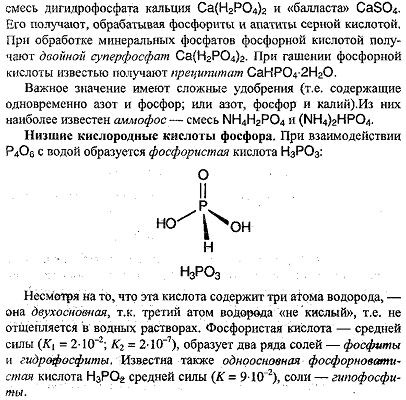
НРО3 - метафосфорная кислота ( на самом деле полимеризована) - сильная
Н4Р2О7 - пирофосфорная кислота - сильная
Н3РО4 - ортофосфорная - по 1-ой ступени диссоциации это кислота средней силы.
Средние соли Н3РО4 называются ортофосфатами (чаще просто фосфатами), кислые - гидрофосфатами и дигидрофосфатами. В воде растворимы фосфаты и гидрофосфаты щелочных металлов, фосфаты и гидрофосфаты остальных металлов плохорастворимы. Все дигидрофосфаты хорошо растворимы в воде. В водных растворах фосфаты и гидрофосфаты гидролизованы, дигидрофосфаты гидролизу не подвергаются, например: Na3PO4 создает сильнощелочную среду, Na2HPO4 - слабощелочную, NaH2PO4 - слабокислую.
Получение фосфорного ангидрида и фосфорной кислоты.
P2O5 можно получить сжиганием фосфора на воздухе или в кислороде:
4P + 5O2 = 2P2O5
Ортофосфорную кислоту получают в промышленности двумя способами:
1. Вытеснением из фосфорита серной кислотой (получается “экстракционная” кислота):
Ca3(PO4)2 + 3H2SO4= 3CaSO4 + 2H3PO4
2. Сжиганием фосфора и растворением образующегося фосфорного ангидрида в воде (“термическая” кислота):
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
Иногда термическую фосфорную кислоту получают, действуя на фосфор перегретым (800-900oС) водяным паром:
2P + 8H2O = 2H3PO4 + 5H2
Применение.
Фосфорную кислоту применяют в промышленности для:
а) получения фосфорных удобрений
б) фосфатирования металлов, например железа - создания на поверхности металла слоя нерастворимого фосфата
в) умягчения воды
г) огнестойкой пропитки
Соли фосфорной кислоты - фосфаты - применяются в качестве удобрений. Основной задачей получения фосфорных удобрений является перевод нарастворимого фосфата Ca3(PO4)2 в растворимые в воде или в кислых почвах ди- и гидрофосфат.
Неорганические соединения фосфора, в первую очередь неорганический фосфат крови, играют существенную роль в поддержании кислотно-щелочного равновесия. Фосфор входит в состав важнейших органических фосфорилированных соединений организма: нуклеотидов, нуклеиновых кислот, фосфолипидов, фосфопротеидов, фосфорных эфиров углеводов, витаминов, коферментов и других соединений, участвующих в различных метаболических процессах и играющих ключевую роль в жизнедеятельности организма.
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и других органических соединений. Благодаря особенностям химические строения атомы Фосфора, подобно атомам серы, способны к образованию богатых энергией связей в макроэргических соединениях: аденозинтрифосфорной кислоте (АТФ), креатинфосфате и других. В процессе биологической эволюции именно фосфорные соединения стали основными, универсальными хранителями генетической информации и переносчиками энергии во всех живых системах. Другая важная роль соединений Фосфора в организме заключается в том, что ферментативное присоединение фосфорильного остатка к различным органическим соединениям (фосфорилирование) служит как бы "пропуском" для их участия в обмене веществ, и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена фосфора - киназы, фосфорилазы и фосфатазы. Главную роль в превращениях соединений фосфора в организме человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
