
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность

Фосфор (символ Р - от латинского Phosphorus) - порядковый номер 15, строение внешнего электронного уровня 3s23p3(электронный аналог азота). В соединениях проявляет степени окисления от -3 до +5, наиболее устойчивы положительные степени окисления +5 и +3.
В природе один стабильный изотоп фосфора - 31Р.
Фосфор в свободном состоянии в природе не встречается. Основными минералами фосфора являются: Ca3(PO4)2 - фосфорит и Ca3(PO4)2*CaX2, где Х+ОН, F, Cl - апатит. Фосфор содержится в живых организмах: входит в состав костей как один из основных компонентов, в состав нуклеиновых кислот. Массовая доля фосфора в земной коре составляет 0,001.
Простое вещество.
Фосфор имеет несколько аллотропных модификаций:
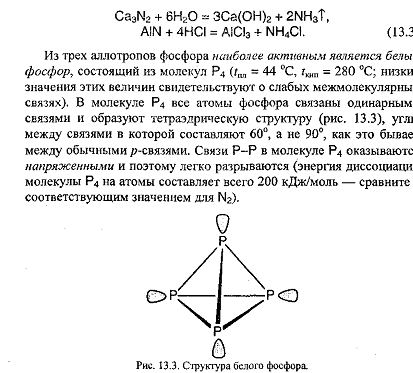
а) белый фосфор - состоит из молекул Р4
б) красный фосфор - высокомолекулярное вещество
в) черный фосфор - атомные кристаллы со структурой, близкой к структуре графита.
Физические свойства.
Белый фосфор - воскообразное вещество желтоватого цвета с чесночным запахом, легко плавится, летуч, хорошо растворим в CS2, очень ядовит, температура плавления +44oС, кипения +287oС, плотность 1,82 г/см3.
Красный фосфор - твердое вещество без запаха, красного цвета, при нагревании возгоняется, плавится только при повышенном давлении, нерастворим в воде и сероуглероде, плотность 2,36 г/см3, неядовит.
Черный фосфор - серо-черное вещество, по твердости напоминающее графит, без запаха, при нагревании возгоняется, плавится только при повышенном давлении, нерастворим в воде и S2, плотность 2,17 г/см3, неядовит.
Аллотропные модификации могут переходить одна в другую, например:
а) белый фосфор переходит в красный при нагревании белого фосфора без доступавоздуха до 300oС.
б) красный фосфор переходит в белый при быстрой конденсации паров фосфора.
в) белый фосфор переходит в черный при ударном прессовании под давлением 10000 МПа (100000 ат) или при 380oС в присутствии ртути.
Химические свойства.
Наиболее химически активен белый фосфор, активность красного и черного фосфора ниже. Разница в активности выражается в том, что те реакции, которые протекают с участием белого фосфора при комнатной температуре, с участием красного и черного фосфора требуют предварительного нагревания.
С водородом фосфор непосредственно не взаимодействует. Фосфор реагирует с простыми веществами:
а) галогенами, например, хлором:
2P + 3Cl2 = 2PCl3 - при избытке фосфра
2P + 5Cl2 = 2PCl5 - при избытке хлора
б) кислородом:
4P + 3O2 = 2P2O3 - при недостатке кислорода
4P + 5O2 = 2P2O5 - при избытке кислорода
Белый фосфор окисляется кислородом уже при комнатной температуре, энергия при этом выделяется в основном в виде света, именно этим объясняется свечение белого фосфора.
в) с серой при нагревании:
2P + 3S = P2S3 - при недостатке серы
4P + 3S = P4S3 - при избытке фосфора
2P + 5S = P2S5 - при избытке серы
д) с металлами при нагревании, например:
3Ca + 2P = Ca3P2
при этом образуются фосфиды металлов
Фосфор реагирует также со сложными веществами:
а) белый фосфор реагирует с кипящим раствором щелочи:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
б) окисляется азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
Получение фосфора.
В промышленности фосфор получают восстановлением фосфата кальция коксом в присутствии SiO2 в качестве шлакообразователя в электропечах при 1500oС:
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3 + 10C + P4
пары фосфора конденсируют водой, при этом получают белый фосфор. При необходимости белый фосфор переводят в красный нагреванием при 300oС без доступа воздуха.
Применение фосфора.
Фосфор применяют для:
а) получения фосфорной кислоты
б) в спичечной промышленности
в) получения полупроводниковых материалов
