
- •62. Биологическое значение d-элементов vIгруппы. Химические основы применений соединений хрома, молибдена и вольфрама в фармации( фармацевтическом анализе).
- •64. Марганец (II) и марганец (IV): ко и ов характеристика соединений. Способность к комплексообразованию.
- •66 Соединений марганец VI: манганаты ,их образоние ,термическая устойчивость ,диспропорционирование в растворе и условия стабилизации.
- •69 Общая характеристика элементов семейства железа .Железо. Химическая активность простого вещества, способность к комплексообразованию.
- •Вопрос 73. Общая характеристика элементов семейства платины.
- •Вопрос 74.D- элементы первой группы. Общая характеристика группы. Физические и химические свойства простых веществ.
- •Вопрос 78 d-Элементы II группы Общая характеристика группы.
- •Вопрос 80 Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
- •82.Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •Вопрос90Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
- •Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
- •Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
- •Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
- •Вопрос 101 Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность
- •Вопрос 102 Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота
- •Вопрос 104 Элементы подгруппы мышьяка. Общая характеристика
- •Вопрос 105 Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша
- •Вопрос 107.
- •Вопрос 109. Кислород, его общая характеристика и нахождения в природе
- •110. Пероксид водорода h2o2
- •§ 2.5. Галогеноводороды
- •Межгалогенные соединения
- •Вопрос 120.
Вопрос 94. Элементы подгруппы Германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа эг2 и эг4, поведение в водных растворах.
Ge(германий), Sn(олово) , Pb(свинец) слева направо уменьшение энергии ионизации и ЭО, увеличение радиуса, неметалические свойства ослабевают германий и олово устойчивы по отношению к воздуху и воде, а свинец окисляется на воздухе.
Ge получают путем переработки цинковых руд, а Sn и Pb – путем восстановления их из оксидов: PbS + O2 = 2PbO + 2SO2 (1)
PbO + C = Pb + CO (2) Типичные металлы, В масле олово более активное, чем железо. Вода на германий и олово не действует, но вода снимает оксидную пленку со свинца, и кислород взаимодействует со свинцом. Ge располагается между Cu и Ag в ряду напряженности, поэтому он не взаимодействует с кислотами. А олово и свинец реагируют с кислотами. Pb растворяет HNO3, а Sn и Ge-царская водка (3 HCl : 1HNO3) 3Sn + 12HCl + 4HNO3 = 3SnCl4 +4NO+8H2O Все производные свинца сильные яды Pb+2HCl=PbCl2↓ +H2 На германий щелочь не действует, действует на олово и свинец. Sn+2NaOH=Na2SnO + H2 степень окисления +4 характерна всем элементам преход от +2 к +4 легче протекает в щелочной среде переход олова из +4 в +2 легче протекает в кислой среде. Ge(OH)4, Sn(OH)4, Pb(OH)4 кислотные свойства уменьшаются слева направо Ge(OH)2, Sn(OH)2, Pb(OH)2 основные свойства увеличиваются слева направо Соли германия, олова и свинца со степенью окисления +4 в водных растворах подвергаются сильному гидролизу. взаимодействие с водородом:
герман GeH4, станнан SnH4, плюмбан PbH4 Очень нестоек. Разлагается с выделением водорода. PbH4 = Pb + 2H2 Взаимодействует с кислородом:
PbH4+2О2=PbО2+Н2О.
При нагревании взаимодействуют с галогенами с образованием PbГ2 . Все они малорастворимы в воде. Получены также галогениды PbГ4: тетрафторид PbF4 — бесцветные кристаллы и тетрахлорид PbCl4 — жёлтая маслянистая жидкость. Оба соединения легко разлагаются, выделяя F2 или Cl2; гидролизуются водой. Галогениды Ge,Sn, Pb способны образовывать комплексные соединения H2[ЭГ6]
Вопрос 97.Р -элементы V группы. Общ. Харак. Азот , фосфор мышьяк в организме, их биологическая роль
![]()
Электронная формула вал. Оболочки атомов элементов ns2np3. Атомы этих элементов имеют 5 валентных электронов наs и p- орбиталях внеш. Уровня. Из них
-
d-уровня.
В возбужд. состоянии
![]()

СО +1,+2,+3,+4,+5,-3. Для азота СО +3,+5,-3, а также +2,+4.


В ряду N-P-As-Sb-Bi наблюдаются следующие закономерности. Увеличения радиуса. Уменьшение энергии ионизации и относительной электроотрицательности.Ослабление неметаллических св-в. N и P-неметалы, As и Sb-Амфотерные, Bi- метал.

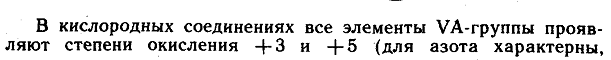
![]() кислотность
уменьшается
кислотность
уменьшается






ных и кислот , но в первую очередь, от содержания витамина Д. Целый ряд соединений фосфора используют в качестве лекарственных препаратов.
Мышьяк. По содер-

![]()
по реакции Марша

Этот пример определения можно взять в 104 вопросе. Коротко четко и ясно.
Вопрос 98 Азот. Общ. Характ. Многообразие соединений с различными степенями окисления азота. Причина Малой химической активности азота. Молекула азота как лиганд
Простое вещество азот — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера. . В технике азот получают фракционной перегонкой жидкого воздуха.. В лаборатории азот получают нагреванием смеси крепких растворов хлорида аммония и нитрита натрия: NH4Cl + NaNO2 = N2 + 2H2O + NaCl или разложением нитрита аммония при нагревании: NH4NO2 = N2 + 2H2O
Наиболее чистый азот получается при термическом разложении азидов металлов, например: 2NaN3 = 2Na + 3N2
Лабораторный способ получения N4NO2------(t)N2+ 2H2O3 CuO+2NH3-----3Cu+3H2O+N2
Химическое строение молекулы азота характеризуется исключительной прочностью, несравнимой ни с какими другими двухатомными молекулами. Особая устойчивость молекулярного азота во многом определяет химию этого элемента. И кратность, и порядок связи в молекуле азота равны трем. Все это является причиной очень большой величины энтальпии диссоциации молекул азота и высокой их термической устойчивости Молекула азота состоит из 2 атомов. Оба атома в молекуле азота крепко связаны. Этим объясняется малая химическая активность свободного азота. При обычных условиях азот не реагирует ни с металлами ( кроме лития), ни с металлоидами. При повышении температуры химическая активность азота увеличивается главным образом по отношению к металлам. Молекула N2 прочна Е=9,49КДЖ/моль
При комнатной температуре азот взаимодействует только с литием, с образованием нитрида лития: N2 + 6Li = 2Li3N,(СО -3) с другими металлами азот взаимодействует при нагревании: N2 + 3Ca = Ca3N2. В реакциях взаимодействия азота с металлами, азот проявляет окислительные свойства, также окислительные свойства он проявляет при взаимодействии с водородом (при нагревании, повышенном давлении и в присутствии катализатора): N2 + 3H2 = 2NH3. Азот также взаимодействует и с другими неметаллами, проявляя при этом восстоновительные свойства: N2+O2 = 2NO(энергия разряд), (СО = +2) N2 + 3F2 =2NF3.(СО= +3) Существуют и другие соединения азота с электроотрицательными элементами, но они являются неустойчивыми, и многие из них, особенно хлористый азот и йодистый азот, взрывчаты.
N2 + 3H2 = 2NH3,
NH3, , нитрид водорода(,амиак) при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта) выделяется при гнеении, проявляет оновные свойства
NН4Cl+ КОН-------t---- KCl+ NH4OH( разлагается NH3 и H2O)
NH3, +Н2О-------NH4OH
NH3H2O==========NH4 катион +OH анион К дис 1,7*10(-3)
Слабый кислотные св-ва
2NH3 +Na=====2NH3Na
Оксонитри́д азо́та(I) (оксид диазота, закись азота, окись азота, веселящий газ) Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Закись азота является озоноразрушающим веществом, а также парниковым газом.
Закись
азота получают нагреванием сухого нитрата
аммония.
Разложение начинается при 170 °C и
сопровождается выделением
тепла.
Поэтому, чтобы не дать протекать ему
слишком бурно, следует вовремя прекратить
нагревание, так как при температурах
более 300 °C нитрат аммония
разлагается со взрывом:
![]()
Более
удобным способом является
нагревание сульфаминовой
кислоты с
73%-й азотной
кислотой:
![]() В химической промышленности
закись азота является побочным продуктом
и для её разрушения используют
каталитические конвертеры, так как
выделение в виде товарного продукта,
как правило, экономически нецелесообразно.
Относится к несолеобразующим
оксидам,
с водой, с растворами щелочей и кислот
не взаимодействует. Не воспламеняется,
но поддерживает горение. Смеси
с эфиром,циклопропаном, хлорэтилом в
определённых концентрациях взрывоопасны.
В нормальных условиях N2O
химически инертен, при нагревании
проявляет свойства окислителя:
В химической промышленности
закись азота является побочным продуктом
и для её разрушения используют
каталитические конвертеры, так как
выделение в виде товарного продукта,
как правило, экономически нецелесообразно.
Относится к несолеобразующим
оксидам,
с водой, с растворами щелочей и кислот
не взаимодействует. Не воспламеняется,
но поддерживает горение. Смеси
с эфиром,циклопропаном, хлорэтилом в
определённых концентрациях взрывоопасны.
В нормальных условиях N2O
химически инертен, при нагревании
проявляет свойства окислителя:
![]()
![]()
При
взаимодействии с сильными окислителями
N2O
может проявлять свойства восстановителя:
![]()
При
нагревании N2O
разлагается:
![]()
NO — несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации около 17 кДж/моль. Жидкий оксид азота(II) на 25 % состоит из молекул N2O2, а твёрдый оксид целиком состоит из них.
В
лаборатории
![]()
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
![]()
![]()
Промышленный
способ основан на окислении аммиака при
высокой температуре и давлении при
участии Pt, Cr2O3 (каккатализаторов):
![]()
Химические
св-ва
![]()
![]()
![]()
N2O3 — жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °CПолучение
![]()
При
пропускании электрического разряда
через жидкий воздух N2O3 можно
получить в виде порошка голубого цвета:
![]()
![]()
![]()
Хим.
Св-ва![]()
.Являясь
азотистым ангидридом, при взаимодействии
с водой N2O3 даёт азотистую
кислоту:
и её соли
![]()
![]() NO2 —
газ, красно-бурого цвета, с характерным
острым запахом или желтоватая жидкость.
Получение
В
лаборатории NO2 обычно
получают воздействием концентрированной азотной
кислотой на медь:
NO2 —
газ, красно-бурого цвета, с характерным
острым запахом или желтоватая жидкость.
Получение
В
лаборатории NO2 обычно
получают воздействием концентрированной азотной
кислотой на медь:
![]()
термическим
разложением нитрата
свинца
![]()
Кислотный
оксид, ему соответствуют азотная и азотистая кислоты.
NO2 отличается
высокой химической активностью. Он
взаимодействует с неметаллами
(фосфор, сера и углерод горят
в нём). В этих реакциях NO2 —
окислитель:
![]()
![]()
![]()
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
![]()
![]()
![]()
![]()
![]()
N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Получение Путём дегидратации азотной кислоты HNO3 с помощью P2O5:
![]()
![]()
Пропуская сухой хлор над сухим нитратом серебра:
![]()
![]()
Хим.
Св-ва
Типичный кислотный оксид.
N2O5 легко
летуч и крайне неустойчив. Разложение
происходит со взрывом,
чаще всего — без видимых причин:
![]() Растворяется
в воде с образованием азотной кислоты
(обратимая реакция):
Растворяется
в воде с образованием азотной кислоты
(обратимая реакция):
![]()
Растворяется
в щелочах с
образованием нитратов:
![]()
Высококонцентрированная
HNO3 имеет
обычно бурую окраску вследствие
происходящего на свету процесса
разложения:
![]()
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует:
а)
с основными и амфотерными
оксидами:
![]()
б)
с основаниями:
![]()
в) вытесняет слабые кислоты из их солей:
![]()
Азотная кислота в любой концентрации проявляет свойства кислоты окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная
HNO3
![]()
Разбавленная
HNO3
![]()
б) с металлами, стоящими в ряду напряжений левее водорода:
![]()
![]()
![]()
![]()
![]()
При
увеличение концентрации кислоты ![]() увеличение
активности металла
увеличение
активности металла
соль азотной кислоты, содержит однозарядный анион NO3−. Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо растворимы в воде. Нитраты устойчивы при обычной температуре. Соли азотной кислоты при нагревании разлагаются, причём продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:
левее
Mg (кроме Li)
При разложении образуют нитриты и
кислород;
![]()
от
Mg до Cu (включая Li) Дают
при разложении оксид металла, NO2 и
кислород.
![]()
после
Cu Образуют
свободный металл, NO2 и
кислород.
![]()
Термическое
разложение нитрата аммония может
происходить по-разному, в зависимости
от температуры: Температура ниже
270°C:
![]() Температура
выше 270 °C, или детонация:
Температура
выше 270 °C, или детонация:
![]() .
.

Вопрос №100. Соединения азота в положительных степенях окисления. Оксиды. Стерехимия и природа связи. Способы получения. КО и ОВ свойства. Азотная кислота и нитриты. КО и ОВ свойства. Азотная кислота и нитраты. КО и ОВ характеристика. Царская водка. Азот – элемент с седьмым порядковым номером, относящийся к V главной подгруппе второго периода системы. Для азота наиболее характерны степени окисления +3, +5, -3, +2 и +4. В кислородных соединениях для азота характерны степени окисления +1, +2, +3, +4 и +5. Оксид азота N2O3 является кислотным ему соответствует кислота- азотистая HNO2

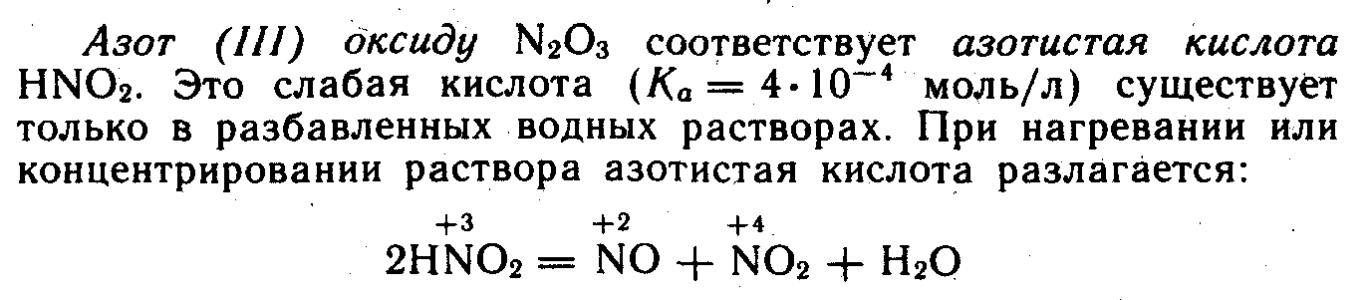

 Способ
получения Азотной кислоты:
Способ
получения Азотной кислоты:
![]()
![]() Способ
получения Азотистой кислоты:
или
Царская
водка
Ца́рская
во́дка (лат. Aqua Regia, Aqua Regis, A.R.) — смесь
концентрированных азотной (65–68% масс.)
и соляной (35–38 % масс.) кислот, взятых в
соотношении 1:3 по объему (массовое
соотношение, в пересчёте на чистые
вещества, около 1:2)
Свойства
Способ
получения Азотистой кислоты:
или
Царская
водка
Ца́рская
во́дка (лат. Aqua Regia, Aqua Regis, A.R.) — смесь
концентрированных азотной (65–68% масс.)
и соляной (35–38 % масс.) кислот, взятых в
соотношении 1:3 по объему (массовое
соотношение, в пересчёте на чистые
вещества, около 1:2)
Свойства
Представляет собой жидкость жёлто-оранжевого цвета с сильным запахом хлора и диоксида азота. Только что приготовленная царская водка бесцветна, однако быстро приобретает оранжевый цвет.
При
взаимодействии HCl и HNO3 образуется сложная
смесь высокоактивных продуктов, в том
числе ассоциатов и свободных радикалов.
Наличие среди продуктов взаимодействия
хлорида нитрозила NOCl и атомарного хлора
in statu nascendi в сильнокислой среде делает
царскую водку одним из сильнейших
окислителей. Смесь готовят непосредственно
перед её применением: при хранении она
разлагается с образованием газообразных
продуктов (именно выделение диоксида
азота придаёт царской водке окраску) и
теряет окислительные
свойства.
![]()
![]()
![]() Эффективность
царской водки как окислителя в значительной
степени связана с уменьшением потенциала
окисления металлов вследствие образования
хлоридных комплексных соединений.
Комплексообразование в сильнокислой
окислительной среде делает возможным
растворение уже при комнатной температуре
даже таких малоактивных металлов, как
золото, платина и палладий:
Эффективность
царской водки как окислителя в значительной
степени связана с уменьшением потенциала
окисления металлов вследствие образования
хлоридных комплексных соединений.
Комплексообразование в сильнокислой
окислительной среде делает возможным
растворение уже при комнатной температуре
даже таких малоактивных металлов, как
золото, платина и палладий:
![]()
![]() Скорость
растворения (травления) золота в царской
водке составляет примерно 10 мкм/мин.
Рутений растворяется в царской водке
только в присутствии кислорода воздуха,
образуя комплексное соединение —
гексахлорорутениевую кислоту[9]. Родий
и иридий в компактном состоянии устойчивы,
но растворяются при нагревании в виде
высокодисперсных порошков (черни)[9].
Скорость
растворения (травления) золота в царской
водке составляет примерно 10 мкм/мин.
Рутений растворяется в царской водке
только в присутствии кислорода воздуха,
образуя комплексное соединение —
гексахлорорутениевую кислоту[9]. Родий
и иридий в компактном состоянии устойчивы,
но растворяются при нагревании в виде
высокодисперсных порошков (черни)[9].
Серебро не растворяется в царской водке из-за пассивации поверхности образующейся плёнкой хлорида серебра. Пассивация поверхности металла кислотоустойчивыми оксидами является причиной устойчивости к царской водке хрома, титана, тантала, циркония, гафния и ниобия.
Царская водка применяется как реактив в химических лабораториях, для очистки стеклянной посуды от следов органических веществ (например, в ЯМР-спектроскопии), в пробирном анализе благородных металлов и их сплавов, при аффинаже золота и платины, получении хлоридов металлов и другого. Стереохимия и природа связи Природа связи-ковалентная неполярная связь Стереохимия: Cтроение молекул оксидов азота
Молекула NO. Строение предположить достаточно просто: у кислорода два неспаренных электрона, у азота три – образуется двойная связь и один неспаренный электрон в остатке... Непросто ответить на вопрос, почему такая «нестандартная» молекула устойчива. Кстати, стоит заметить, что устойчивые свободные радикалы – молекулы с неспаренными электронами – в природе достаточно редки. Можно предположить, что молекулы NO будут спариваться и образовывать удвоенную, или димерную, молекулу ONNO. Таким образом удается решить проблему неспаренного электрона.
Молекула NO2. Казалось бы, чего проще – к молекуле NО по неспаренному электрону присоединился атом кислорода. (На самом деле присоединяется не атом, а молекула, и не к NО, а к димеру ОNNO. Поэтому-то и уменьшается скорость присоединения с повышением температуры – димер разваливается на половинки.) И теперь уже у кислорода появился неспаренный электрон – молекула оксида азота(IV) тоже свободный радикал. Однако известно, что при соединении двух молекул NО2 и образовании молекулы N2O4 связь осуществляется через атомы азота, значит, именно у азота и должен бы быть этот самый неспаренный электрон. Как это можно осуществить?
Ответ
нетрадиционен, но вполне в «характере»
азота – донорно-акцепторная связь.
Используя логику, рассмотрим электроны,
которые есть у атома азота в молекуле
NО. Это неспаренный электрон, свободная
пара электронов и еще два электрона на
связи с кислородом – всего пять. А у
атома кислорода, «выходящего на связь»,
шесть электронов на четырех орбиталях.
Если расположить их по два, то одна
орбиталь останется свободной. Вот именно
ее и занимает пара электронов атома
азота, а неспаренный электрон в этой
связи оказывается совершенно ни при
чем
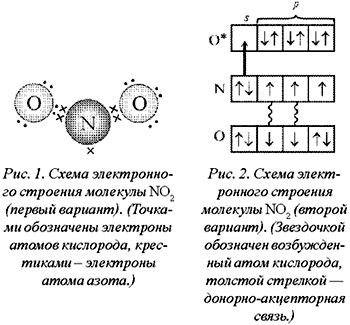 Стоит
упомянуть еще один момент – раз пара
электронов, находящаяся на s-орбитали,
«пошла на связь», она была просто обязана
подвергнуться гибридизации – очень
сложно предложить второму атому в общее
пользование пару электронов, равномерно
распределенную по поверхности первого
атома. Возникает вопрос: какой тип
гибридизации использует атом? Ответ:
три электронные орбитали азота находятся
в состоянии sp2-гибридизации. Молекула
NO2 угловая, угол 134° (угол больше 120°
потому, что один электрон отталкивает
от себя электроны связи слабее, чем пара
электронов)
Стоит
упомянуть еще один момент – раз пара
электронов, находящаяся на s-орбитали,
«пошла на связь», она была просто обязана
подвергнуться гибридизации – очень
сложно предложить второму атому в общее
пользование пару электронов, равномерно
распределенную по поверхности первого
атома. Возникает вопрос: какой тип
гибридизации использует атом? Ответ:
три электронные орбитали азота находятся
в состоянии sp2-гибридизации. Молекула
NO2 угловая, угол 134° (угол больше 120°
потому, что один электрон отталкивает
от себя электроны связи слабее, чем пара
электронов)
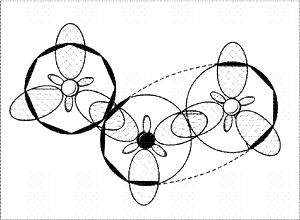
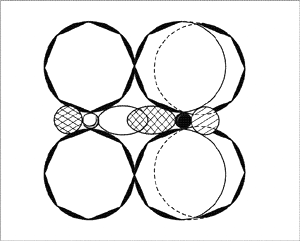 Молекула
NO2
— вид «сверху»
Молекула NO2
– вид «сбоку»,
со
стороны донорно-акцепторной связи.
(Второй атом кислорода
не виден
за
орбиталями атома азота.
Заштрихованные кружки –
это
гибридизованные
орбитали атомов,
направленные к
читателю.)
Молекула
NO2
— вид «сверху»
Молекула NO2
– вид «сбоку»,
со
стороны донорно-акцепторной связи.
(Второй атом кислорода
не виден
за
орбиталями атома азота.
Заштрихованные кружки –
это
гибридизованные
орбитали атомов,
направленные к
читателю.)
