- •Раздел 1. Основы строения и факторы, определяющие реакционную способность органических соединений
- •1.1. Введение в биоорганическую химию. Основные понятия и термины
- •1.2. Классификация и номенклатура органических соединений
- •Классификация органических соединений по строению углеродного скелета
- •Основные функциональные группы и классы органических соединений
- •Классификация органических соединений по наличию функциональных групп
- •Приставки и окончания, применяемые для обозначения некоторых групп в биологически важных соединениях
- •При построении названия соединения:
- •Ациклические углеводороды
- •Карбоциклические углеводороды
- •Гетероциклические соединения
- •1.3. Электронное строение органических соединений
- •1.4. Химические связи атома углерода
- •Бензол как прототип ароматических соединений
- •Гетероциклические ароматические системы.
- •1.6. Электронные эффекты заместителей
- •Характер совместного действия заместителей
- •1.7. Пространственное строение органических соединений. Изомерия.
- •Пространственная изомерия
- •Конфигурационный стандарт – глицериновый альдегид
- •Пространственное строение циклических соединений
- •Типы реагентов и характер изменения связей в реакционном центре субстрата
- •По характеру изменения связей в субстрате и реагенте
- •По направлению (конечному результату)
- •По числу молекул (частиц), участвующих в стадии, определяющей общую скорость реакции
- •Методики выполнения общих качественных реакций на функциональные группы
- •1. Бромирование бромной водой
- •2. Реакция гидроксилирования (реакция Вагнера)
- •Реакция идентификации многоатомных спиртов
- •Идентификация первичных и вторичных спиртов реакцией окисления бихроматом калия в кислой среде
- •Реакция идентификации фенольного гидроксида
- •2. Реакция “медного зеркала”
- •Б. Определение уксусного альдегида
- •Сводные вопросы к теоретическому экзамену по биоорганической химии
- •Теоретические основы строения и реакционной способности органических соединений.
- •II. Общие закономерности реакционной способности органических соединений как химическая основа их биологического функционирования.
- •III. Биополимеры и их структурные компоненты. Липиды.
- •Библиографический список
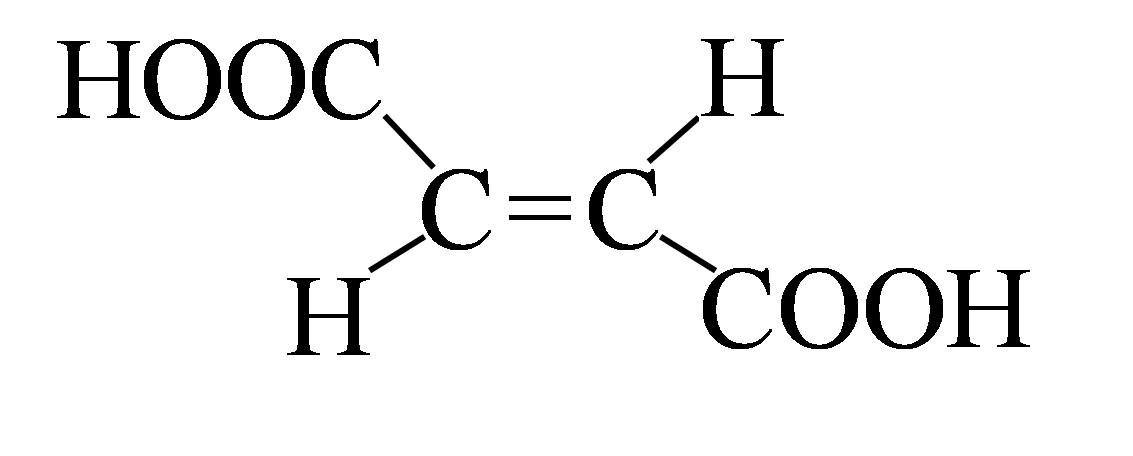
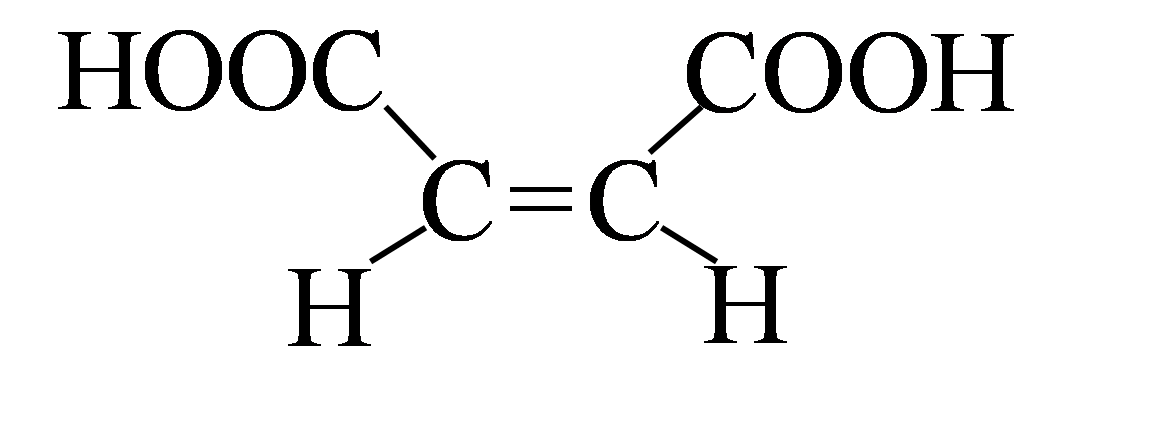
Пространственная изомерия
геометрическая – обусловлена различным расположением заместителей вокруг двойных связей или относительно плоскости циклов).
|
б |
|
|---|---|---|
|
|
|
транс-форма (фумаровая кислота) |
цис-форма (малеиновая кислота) |
Это конфигурационные изомеры, которые не могут быть превращены друг в друга без разрыва ковалентных связей.
Оптическая изомерия
Стереоизомерия связана с различным расположением в пространстве атомов и атомных групп вокруг асимметрического углеродного атома.
Асимметрический атом углерода – это углерод, все четыре валентности которого замещены различными заместителями.
Хиральность – свойство предмета быть неидентичным своему зеркальному отображению (от греч. cheir – рука). Молекулы тоже могут быть хиральными и ахиральными.
Простейший случай хиральности – наличие в молекуле центра хиральности, которым является асимметрический атом углерода.
Вследствие хиральности некоторые молекулы существуют в виде пары стереоизомеров – энантиомеров.
Энантиомеры – это стереоизомеры, относящиеся друг к другу как предмет и его зеркальное отражение, различные по абсолютной и относительной конфигурации, биологическим свойствам, но обладающие одинаковыми физическими и химическими свойствами.
Конфигурационный стандарт – глицериновый альдегид
-
Стереохимическая формула
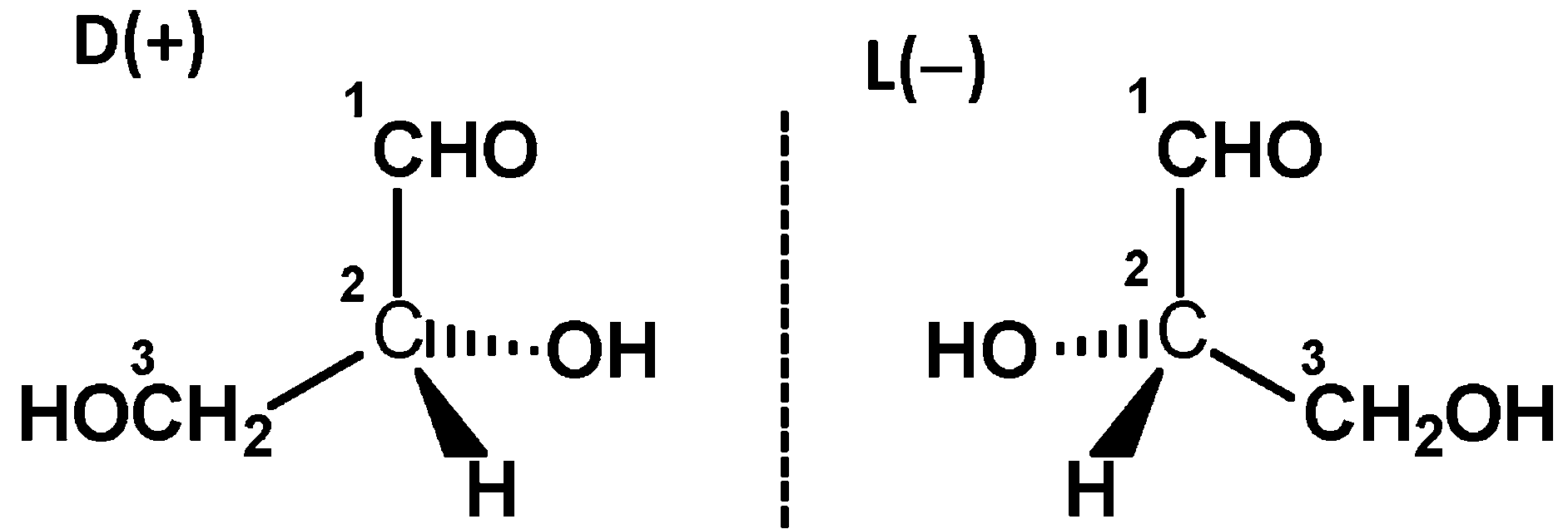
Углеродная цепь расположена сверху вниз
(наверху старшая группа)
Горизонтальные связи выходят вперед из плоскости чертежа, а вертикальные – назад за плоскость чертежа
Формулы Фишера
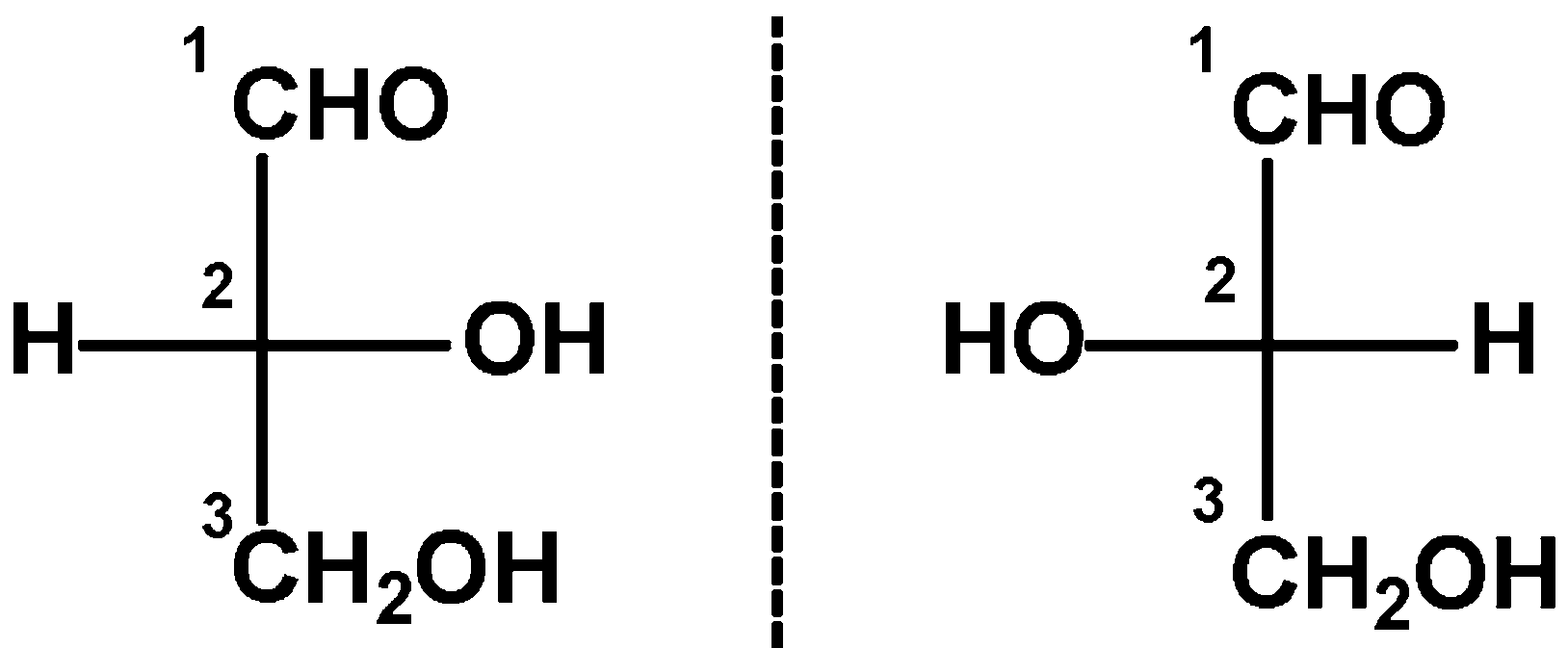
Перестановка двух заместителей изменяет конфигурацию молекулы на противоположную
Энантиомеры отличаются противоположными знаками оптической активности, которая проявляется в способности вещества вращать плоскость поляризованного света.
Так, при прохождении плоскополяризованного света через раствор одного энантиомера происходит отклонение плоскости поляризации влево, другого – вправо на тот же по величине угол – α (удельное вращение).
Левое вращение обозначается знаком (-), правое – знаком (+), а энантиомеры называют соответственно лево- и правовращающими.
Каждое соединение, существующее в виде двух оптических энантиомеров, может иметь и третью, оптически неактивную форму – рацемат.
Рацемат – равномолекулярная смесь двух энантиомеров, когда левое вращение одного энантиомера полностью компенсируется правым вращением другого.
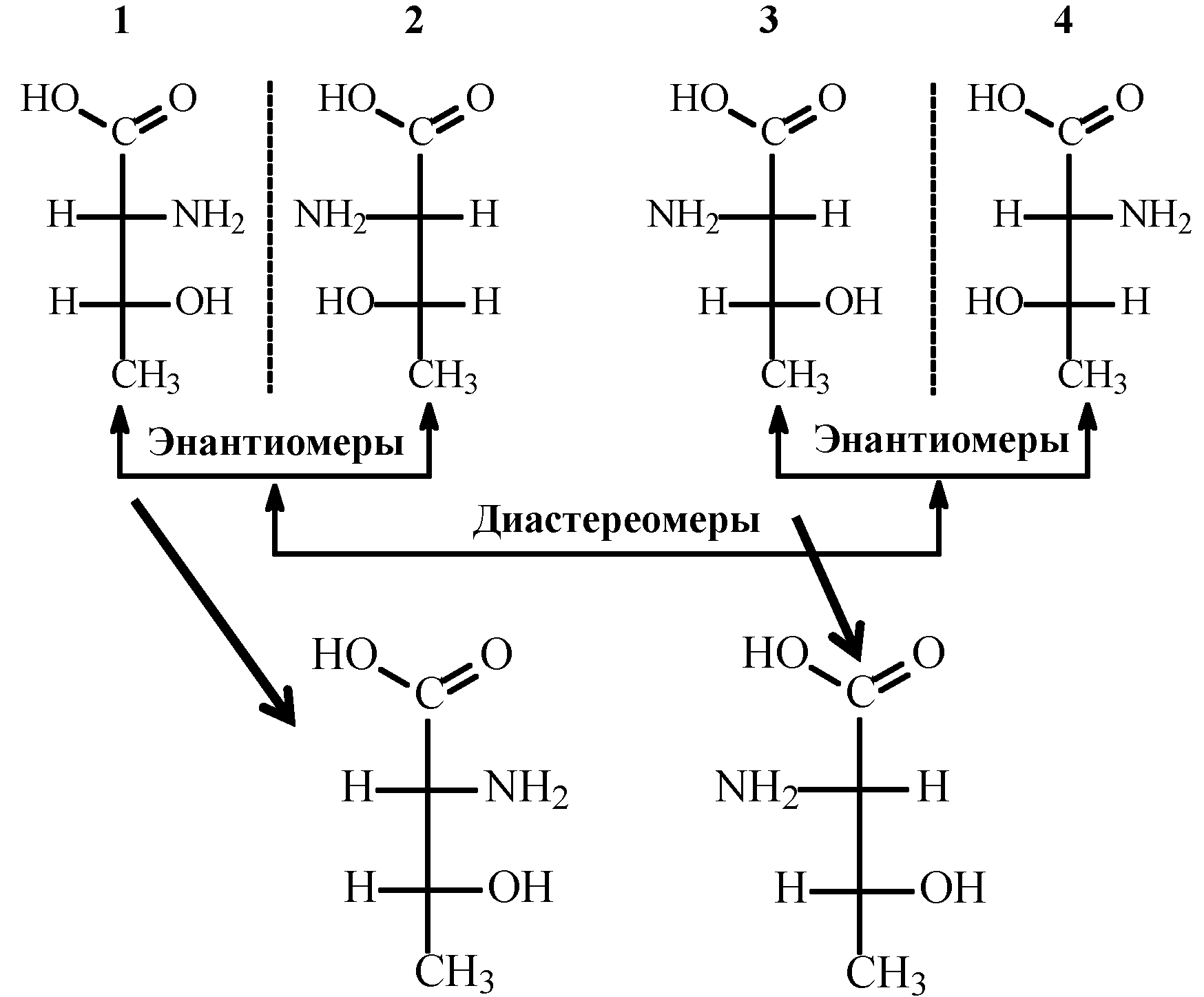
Если в органической молекуле содержится не один ассиметрический атом углерода, а несколько, то наряду с существованием энантиомеров, появляются уже и диастереомеры. (Если в молекуле n ассиметрических атомов углерода, то существуют 2n конфигурационных изомеров или 2n-1 пар энантиомеров).
Диастереомеры – это стереоизомеры, не являющиеся зеркальным отражением один другого и имеющие различные физические, химические и биологические свойства.
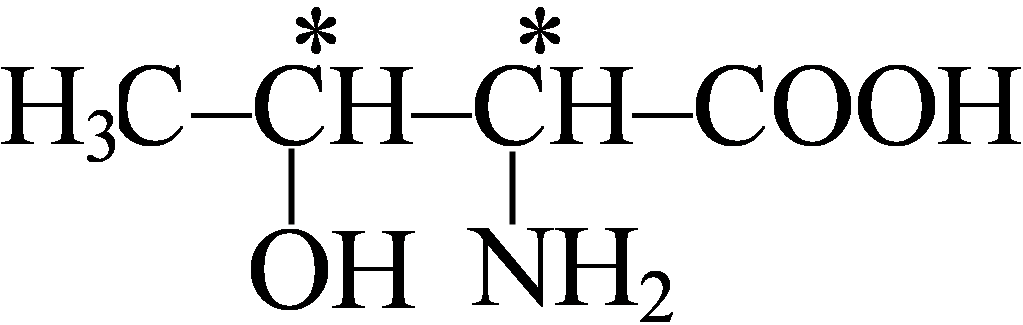
Например: 2 амино-3-гидроксибутановая кислота (треонин)
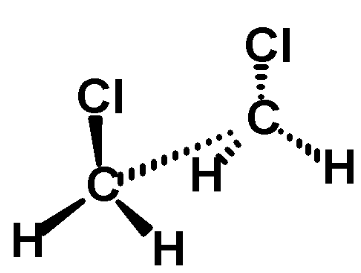
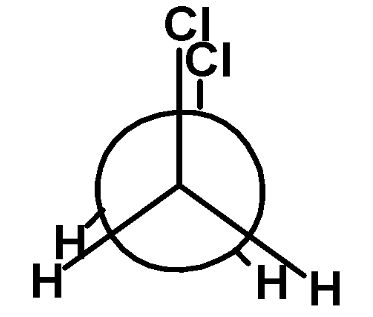
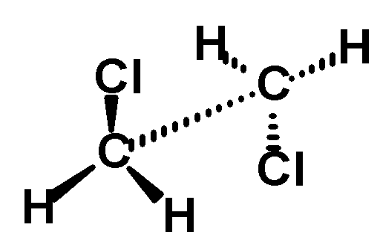
Поворотная изомерия (или конформационная)
Характерна для веществ с sp3-гибридными атомами С, соединенных σ-связью, относительно которой возможно свободное вращение.
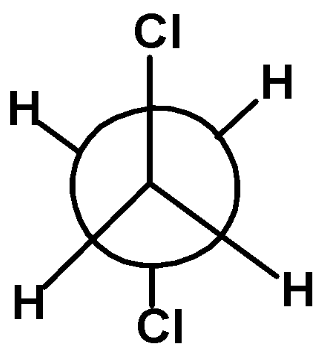
Для изображения конформационных изомеров на плоскости используют проекции Ньюмена.
Взаимное расположение заместителей при вращении их вдоль C–C связи харакетризуется углом поворота относительно друг друга. В зависимости от угла возникают различные конформации, превращающиеся друг в друга.
Конформации 1,2 – дихлорэтана
заслоненная (атомные группы у соседних атомов располагаются одна за другой) Emax |
заторможенная (атомные группы максимально удалены друг от друга) Emin |


 утен-2-диовая
кислота
утен-2-диовая
кислота