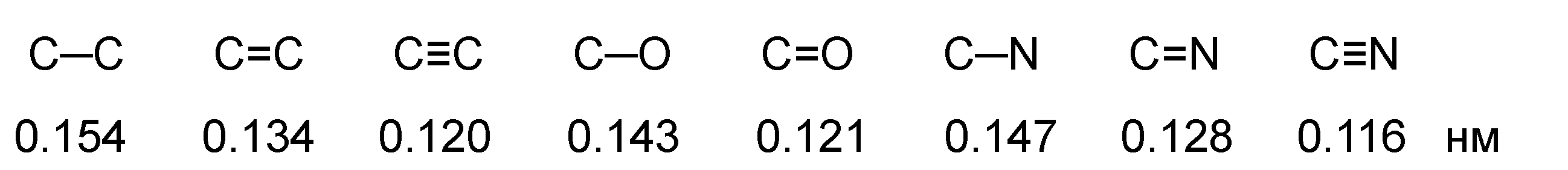- •Раздел 1. Основы строения и факторы, определяющие реакционную способность органических соединений
- •1.1. Введение в биоорганическую химию. Основные понятия и термины
- •1.2. Классификация и номенклатура органических соединений
- •Классификация органических соединений по строению углеродного скелета
- •Основные функциональные группы и классы органических соединений
- •Классификация органических соединений по наличию функциональных групп
- •Приставки и окончания, применяемые для обозначения некоторых групп в биологически важных соединениях
- •При построении названия соединения:
- •Ациклические углеводороды
- •Карбоциклические углеводороды
- •Гетероциклические соединения
- •1.3. Электронное строение органических соединений
- •1.4. Химические связи атома углерода
- •Бензол как прототип ароматических соединений
- •Гетероциклические ароматические системы.
- •1.6. Электронные эффекты заместителей
- •Характер совместного действия заместителей
- •1.7. Пространственное строение органических соединений. Изомерия.
- •Пространственная изомерия
- •Конфигурационный стандарт – глицериновый альдегид
- •Пространственное строение циклических соединений
- •Типы реагентов и характер изменения связей в реакционном центре субстрата
- •По характеру изменения связей в субстрате и реагенте
- •По направлению (конечному результату)
- •По числу молекул (частиц), участвующих в стадии, определяющей общую скорость реакции
- •Методики выполнения общих качественных реакций на функциональные группы
- •1. Бромирование бромной водой
- •2. Реакция гидроксилирования (реакция Вагнера)
- •Реакция идентификации многоатомных спиртов
- •Идентификация первичных и вторичных спиртов реакцией окисления бихроматом калия в кислой среде
- •Реакция идентификации фенольного гидроксида
- •2. Реакция “медного зеркала”
- •Б. Определение уксусного альдегида
- •Сводные вопросы к теоретическому экзамену по биоорганической химии
- •Теоретические основы строения и реакционной способности органических соединений.
- •II. Общие закономерности реакционной способности органических соединений как химическая основа их биологического функционирования.
- •III. Биополимеры и их структурные компоненты. Липиды.
- •Библиографический список
1.3. Электронное строение органических соединений
В составе органических соединений чаще всего находят следующие элементы: C, O, H, N, S, P, которые получили название элементов – органогенов.
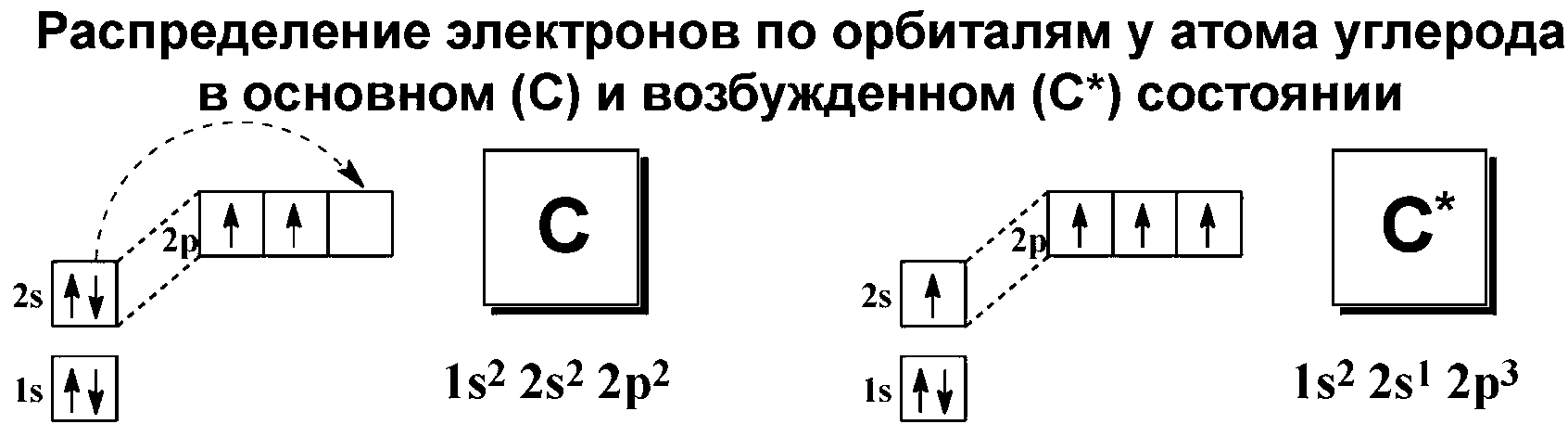
Электронное состояние углерода (невозбужденное) – 1S2 2S2 2P2, при переходе в возбужденное состояние - 1S2 2S1 2P3.
Интерес представляют S и P орбитали, поскольку валентные электроны углерода и элементов-органогенов находятся на них.
Гибридизация орбиталей – смешение нескольких атомных орбиталей различной формы и близкой энергии с образованием такого же числа новых гибридных орбиталей, расположение которых в пространстве соответствует геометрии молекулы. Гибридные орбитали за счет более эффективного перекрывания образуют более прочные связи по сравнению с негибридными.
В органических соединениях углерод может находиться в одном из трех валентных состояний:
I валентное состояние – sp3-гибридизация, при которой происходит смешивание I S и 3 p-орбиталей, с возникновением 4-х гибридизованных орбиталей, расположенных в пространстве под углом 109º28´ по отношению друг к другу. Углерод в таком состоянии получил название тетрагонального атома углерода и встречается в предельных органических соединениях.
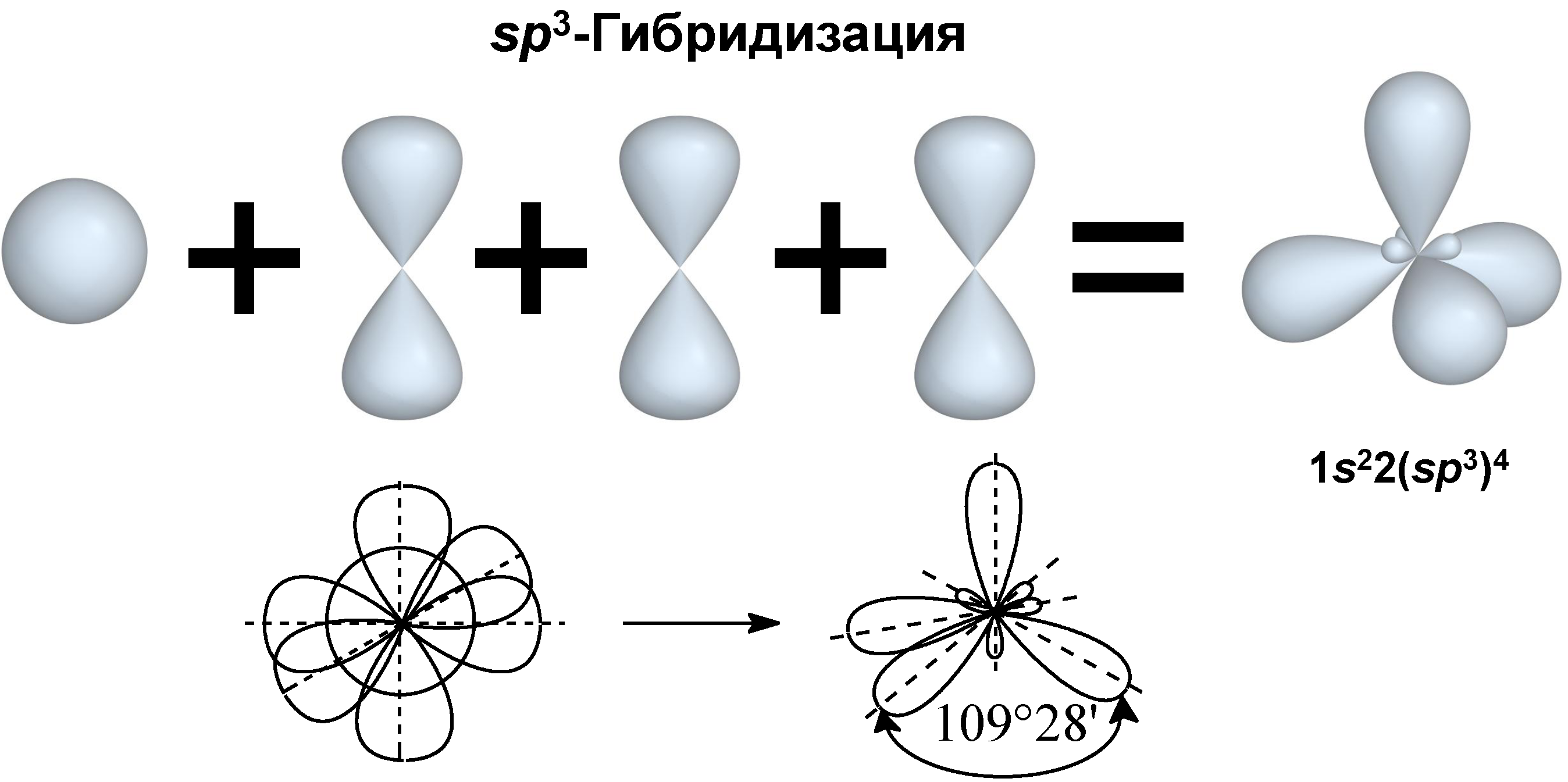
sp3-гибридные орбитали направлены в пространстве к вершинам тетраэдра (тетраэдрическая конфигурация).
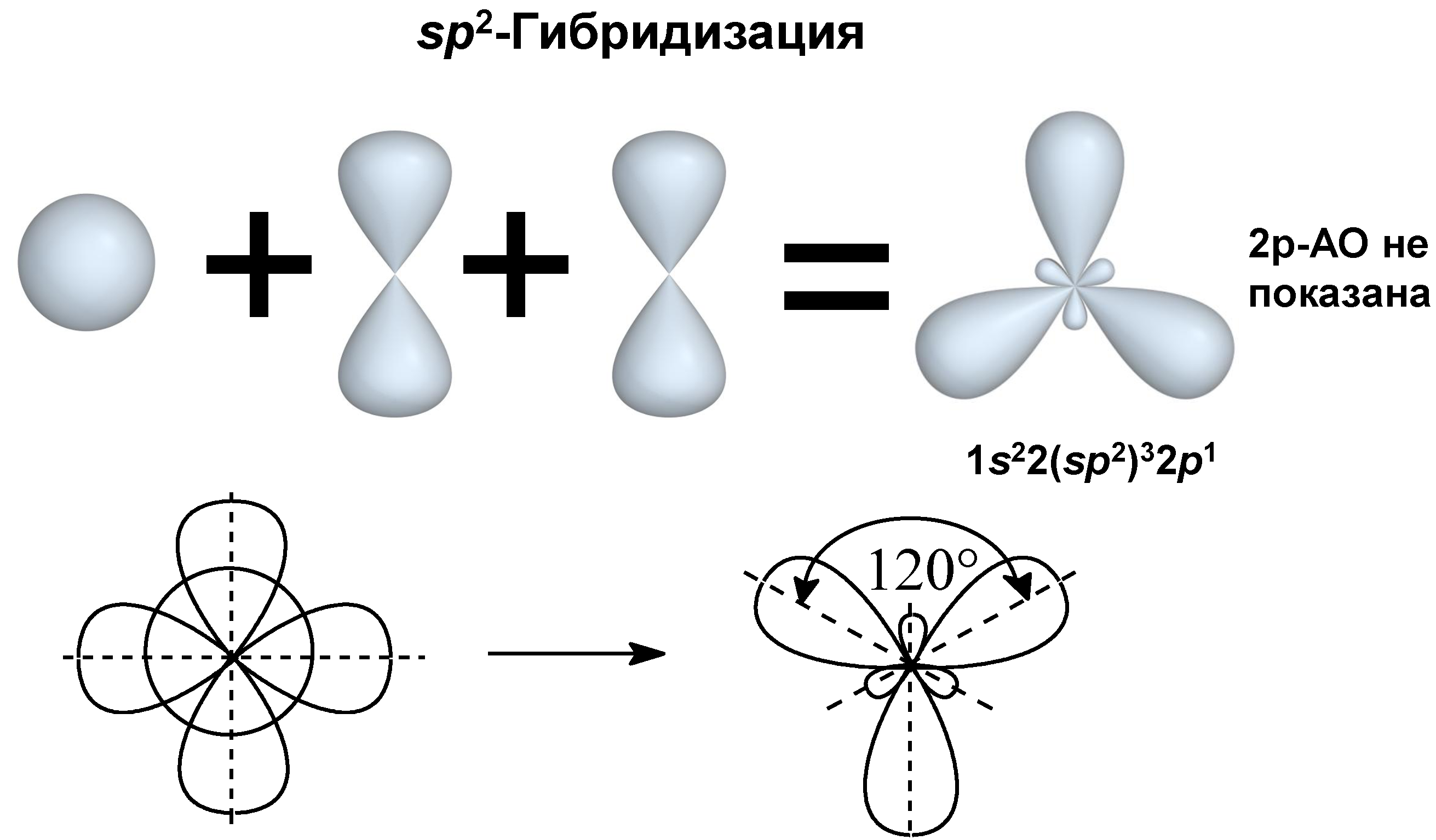
II валентное состояние – sp2-гибридизация, при которой происходит смешивание I S и 2 p-орбиталей, с возникновением 3-х гибридизованных орбиталей, расположенных в одной плоскости под углом 120º по отношению друг к другу. Негибридизованная p-орбиталь расположена перпендикулярно плоскости гибридизованных орбиталей. Углерод в таком состоянии называют тригональным и встречается он в соединениях с двойными связями (атом C в алкенах, карбонильной и карбоксильной группах).
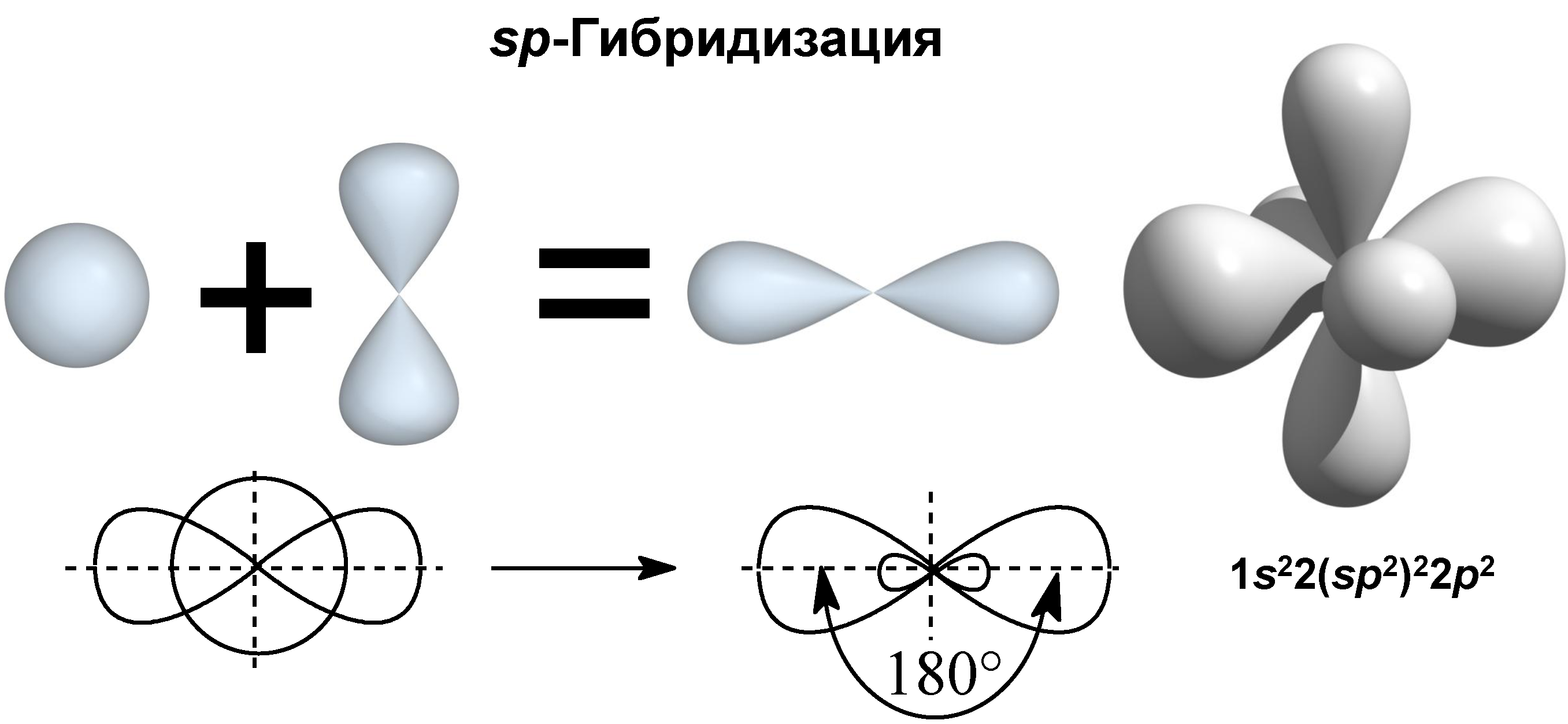
III валентное состояние – sp-гибридизация, при которой происходит смешивание I S и 1p-орбитали с возникновением 2-х гибридизованых орбиталей, расположенных в пространстве под углом 180º (линейно), а две негибридизованые p-орбитали расположены взаимно перпендикулярно друг другу. Sp-гибридизация характерна для углерода, связанного тройной связью или двумя двойными связями.
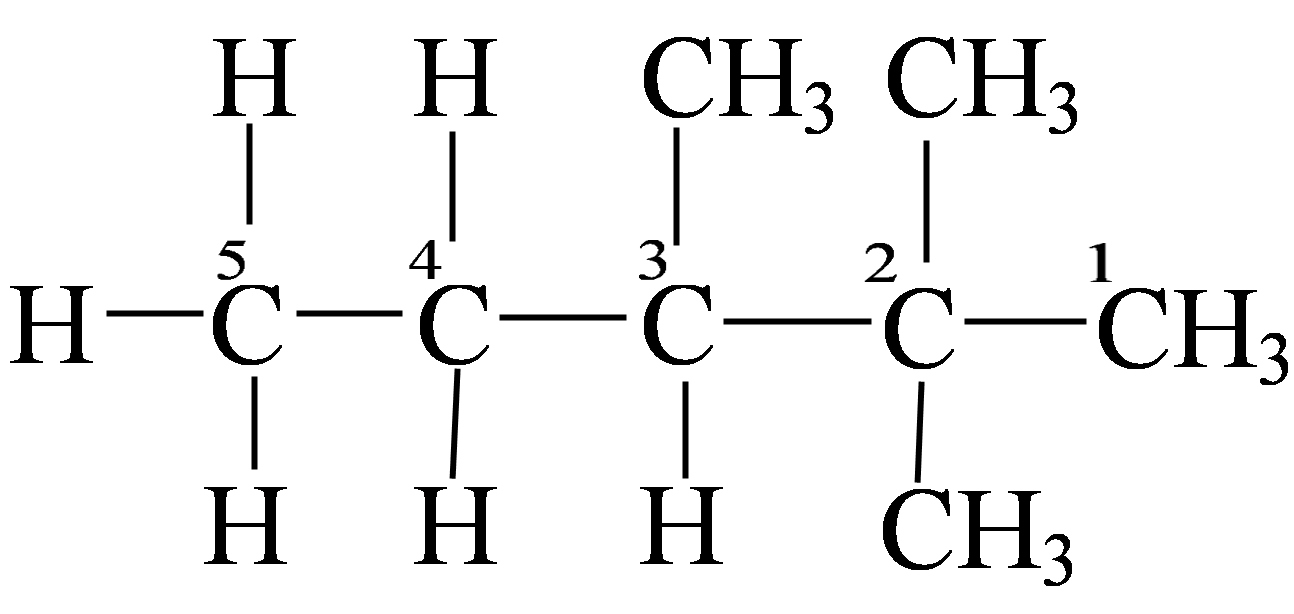
Если углерод образует одну углерод-углеродную связь, то его называют первичным, если две углерод-углеродные связи − то вторичным; если три углерод-углеродные связи – то третичным; если четыре углерод-углеродные связи – то четвертичным.
Например:
1-й и 5-й углероды – первичные; 4-й – вторичный; 3-й – третичный;
2-ой – четвертичный.
1.4. Химические связи атома углерода
Ковалентная связь – это химическая связь, образованная в результате обобществления электронов связываемых атомов.
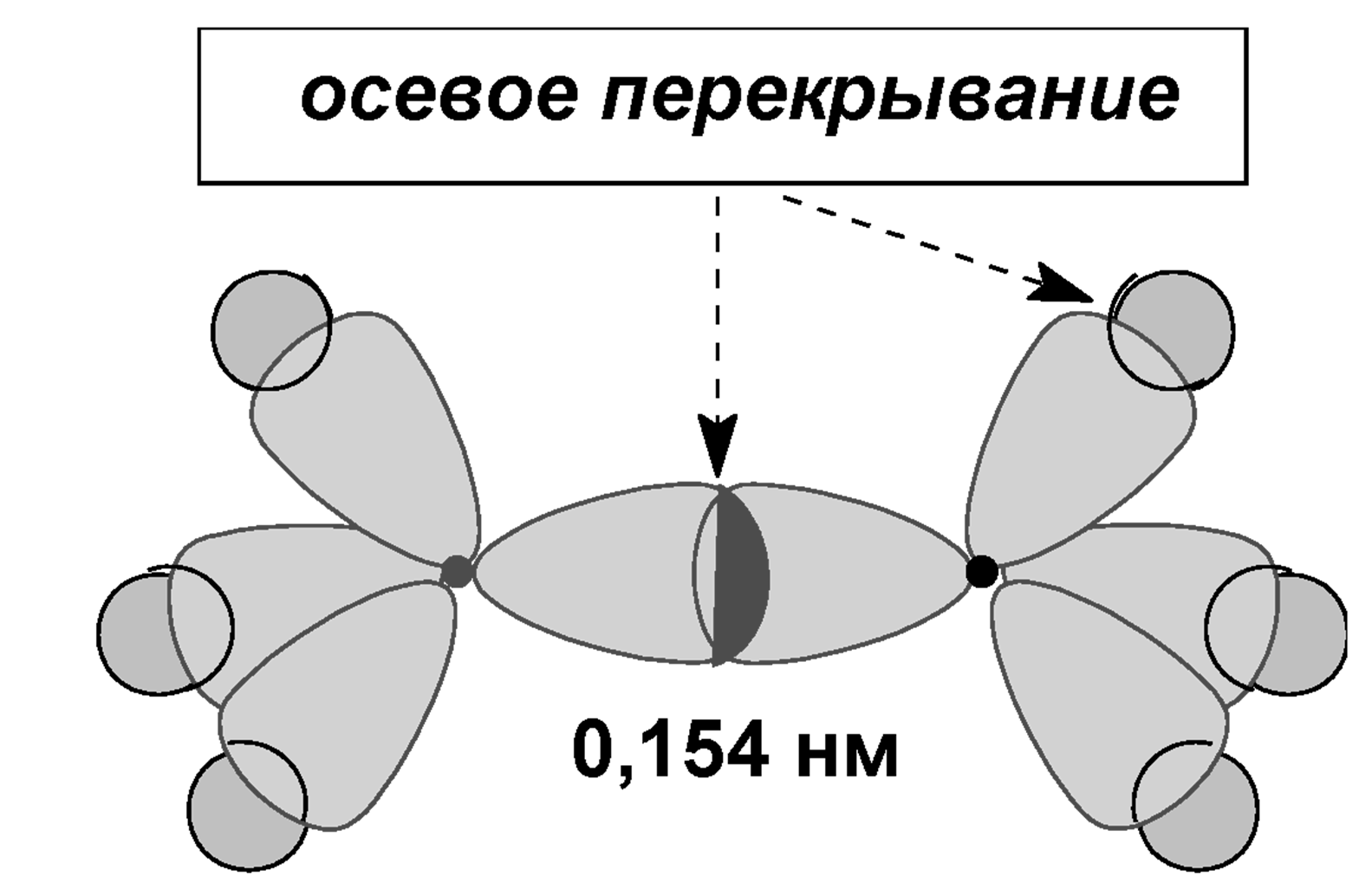
σ-связь – ковалентная одинарная связь, которая образуется при перекрывании гибридных и негибридных АО с максимальным перекрыванием по прямой, соединяющей ядра атомов.
π-связь − ковалентная связь, которая образуется за счет бокового перекрывания негибридных p-атомных орбиталей с максимумом перекрытия по обе стороны от прямой, соединяющей ядра атомов.
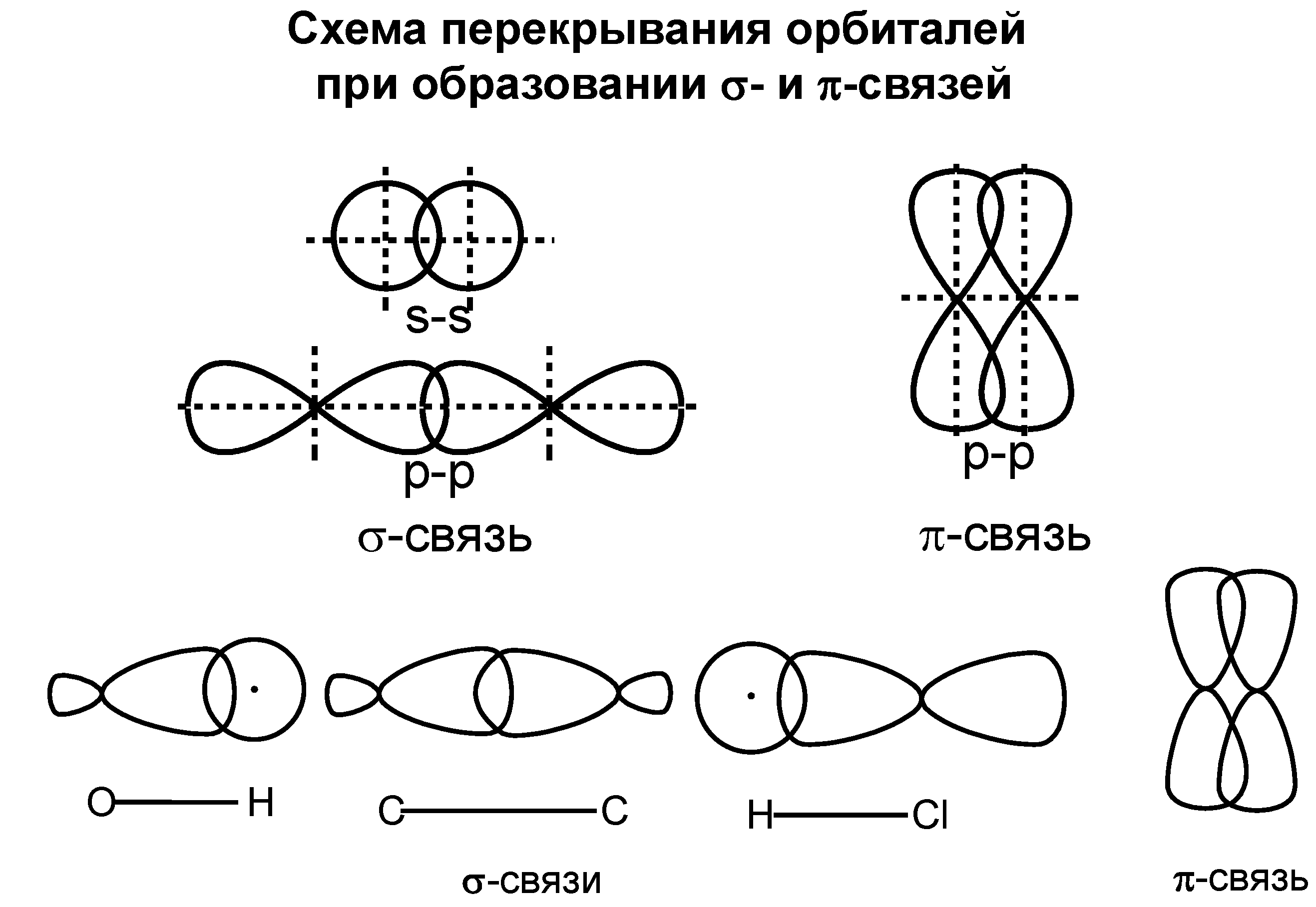
Схема перекрывания орбиталей при образовании σ-связей с участием атома углерода
Образование σ-связей в этане
|
-
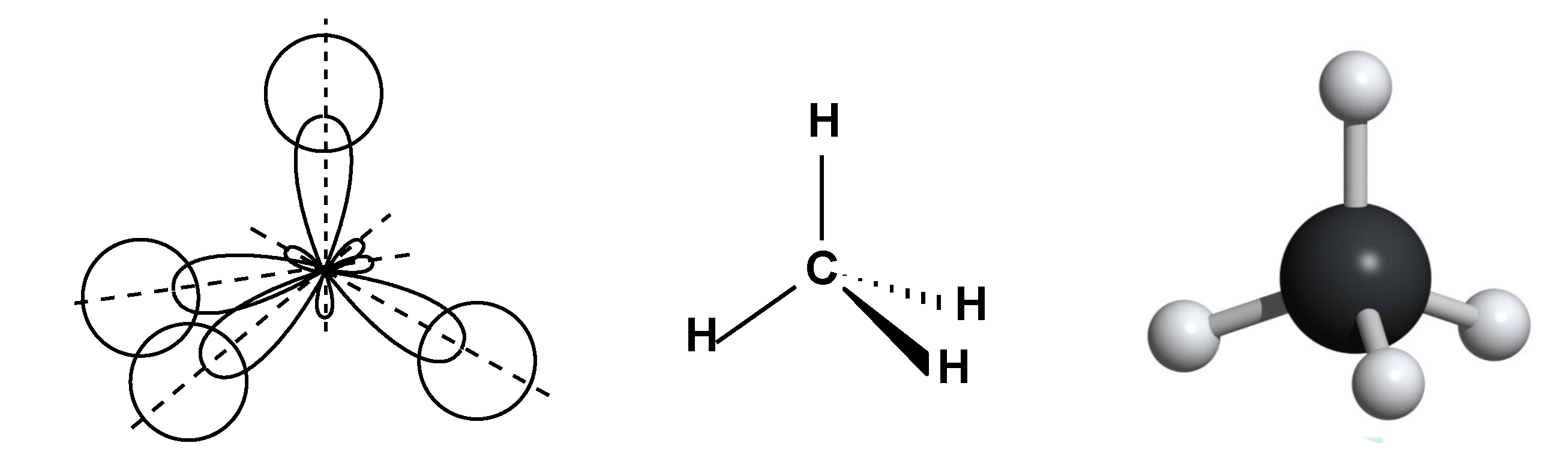
метан CH4 – тетраэдрическая молекула
Кратные связи
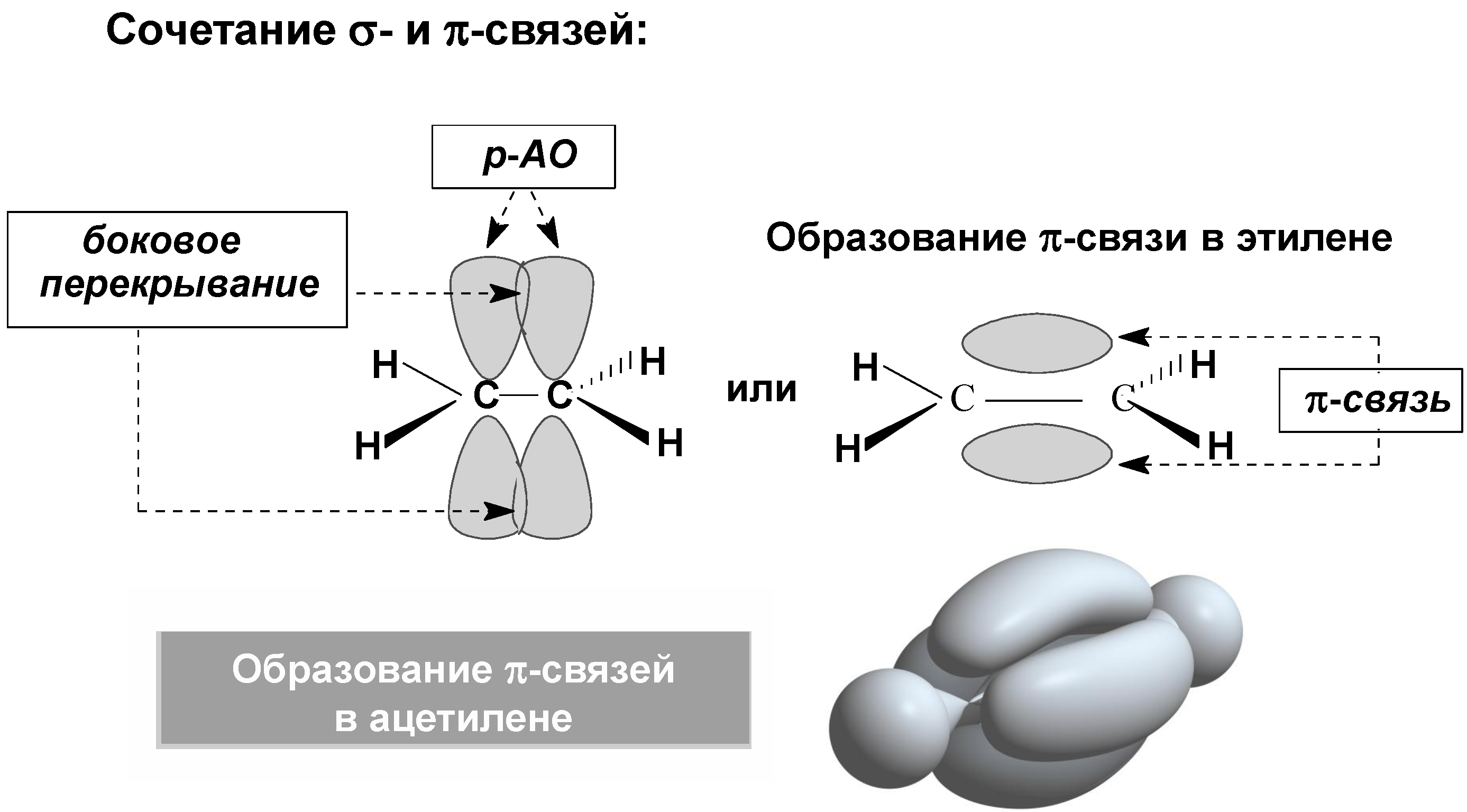
Характеристики ковалентной связи
(длина, энергия, полярность, поляризуемость)
|
Длина связи – это расстояние между центрами связанных атомов.
Энергия связи – это энергия, которая выделяется при образовании связи или необходимая для разъединения двух атомов.
1.5. Сопряжение
Молекулы с чередующимися двойными π и простыми σ связями называют сопряженными системами.
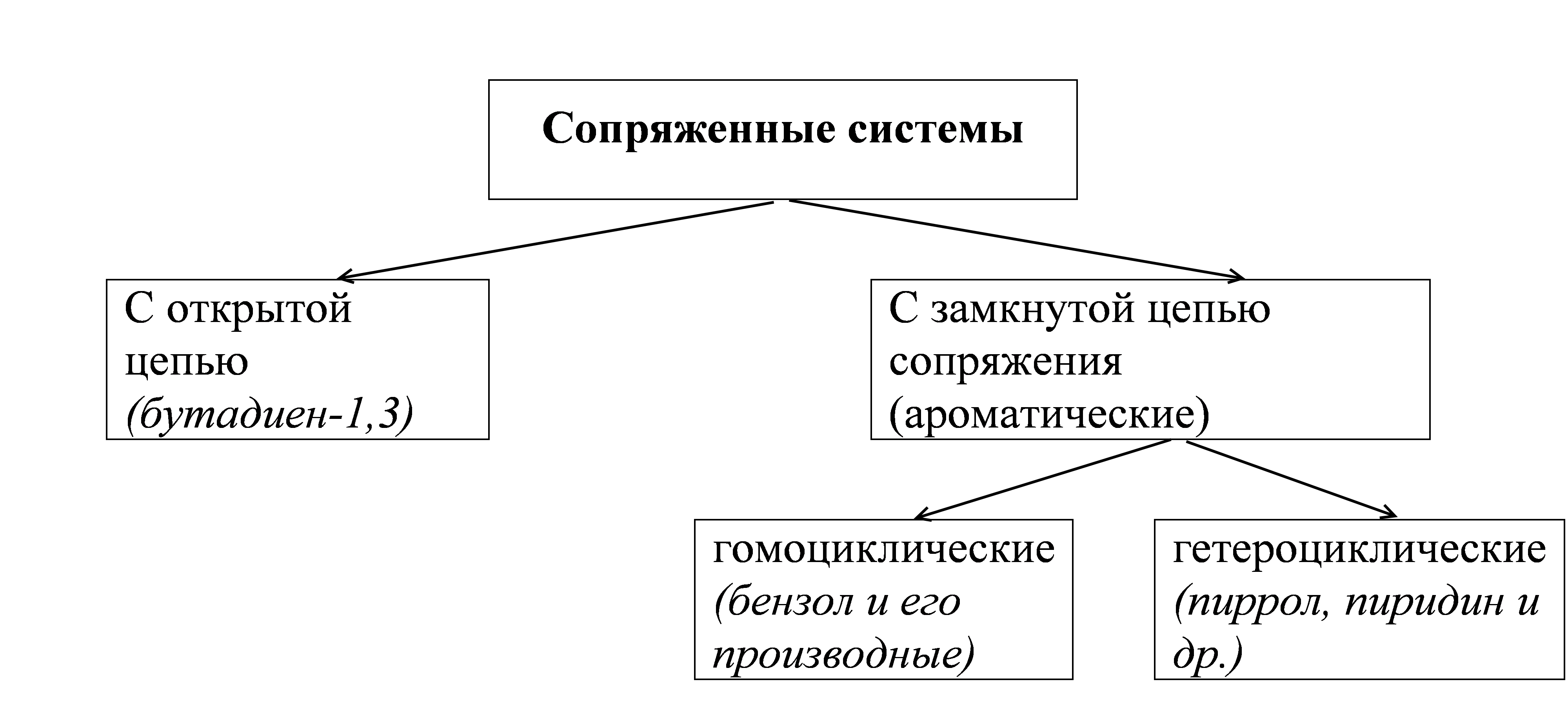
Сопряжение – это перераспределение электронной плотности в системе π – связей, приводящее к стабилизации молекулы.
Энергия сопряжения – это уменьшение энергии молекулы благодаря сопряжению.
Открытые системы сопряжения
Бутадиен-1,3, каждый из четырех углеродов в состоянии sp2-гибридизации, у каждого углерода – по одной свободной p-орбитали. В результате бокового перекрывания орбиталей происходит сопряжение двух локализованных двойных связей с образованием делокализованной четырехцентровой молекулярной орбитали. Этот вид сопряжения называют π-π-сопряжение. Есопряж. = 250 кДж/моль – 235 кДж/моль = 15 кДж/моль. Наблюдается выравненность электронных плотностей в результате делокализации электронов, создание единого электронного облака.
Делокализация электронов в циклических соединениях приводит к возникновению ароматических систем.
Правила ароматичности.
1. Наличие плоского цикла (кольца), состоящего из sp2-гибридизованных атомов, образующих σ-скелет (молекула копланарна).
2. Делокализация электронов, приводящая к образованию единого электронного облака (π-секстет).
3. Подчинение правилу Э. Хюккеля, т.е. электронное облако должно насчитывать (4n+2) π-электронов, где n=1,2,3,4…
4. Высокая степень термодинамической устойчивости (энергия сопряжения).
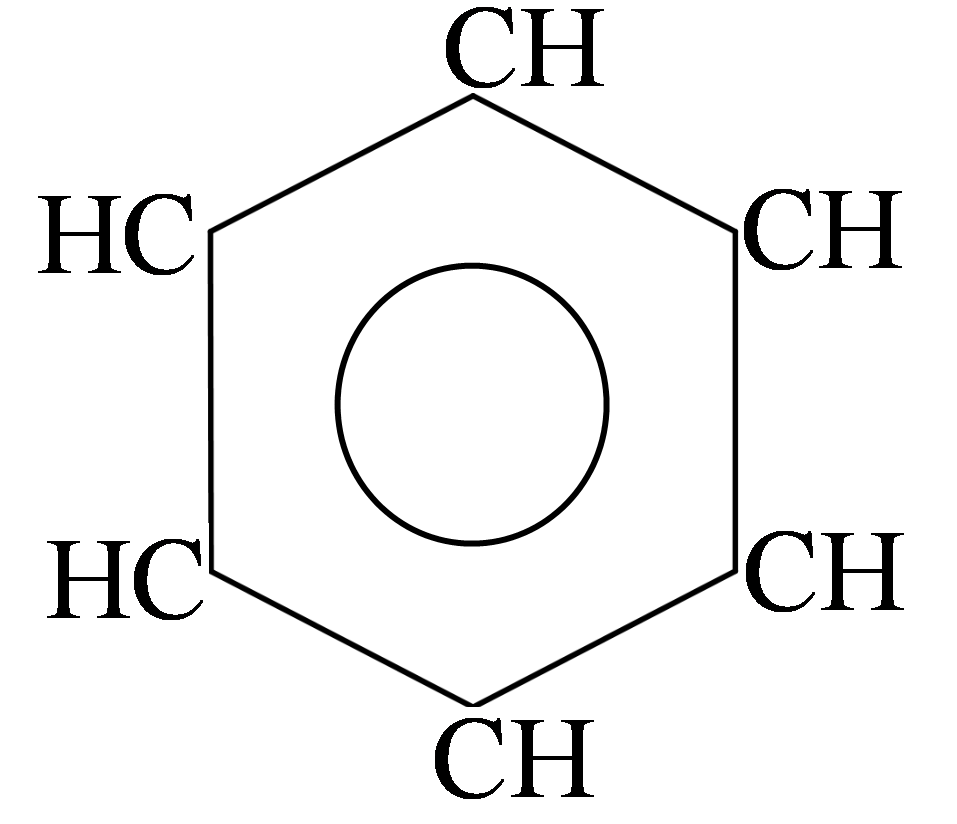
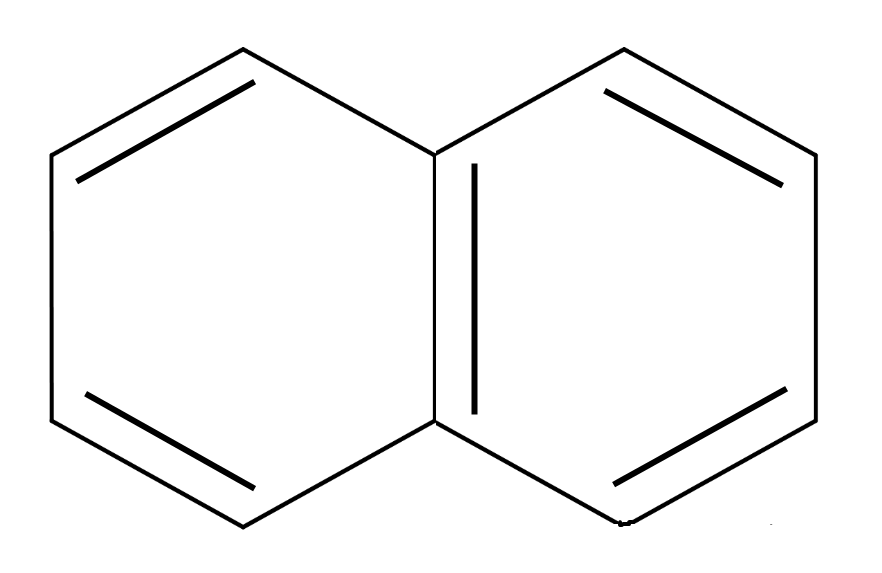
Гомоциклические ароматические системы.
бензол n=1 6ē делокализовано в π- секстет
|
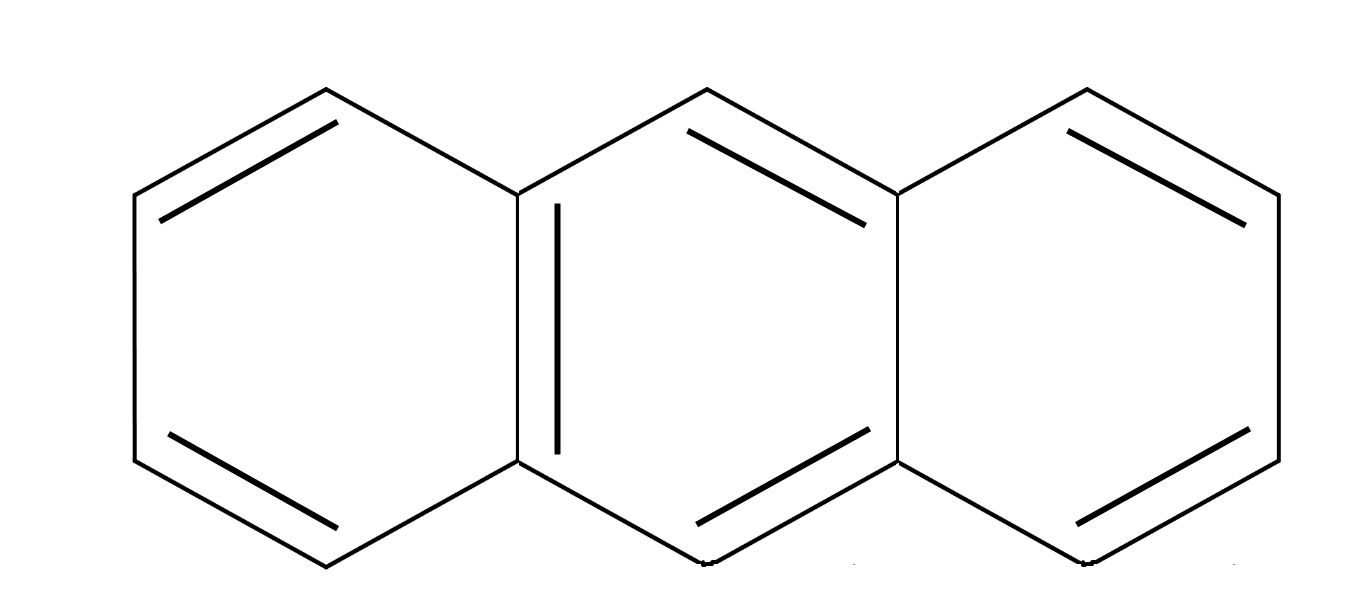
нафталин n=2 10ē делокализовано |
|
антрацен
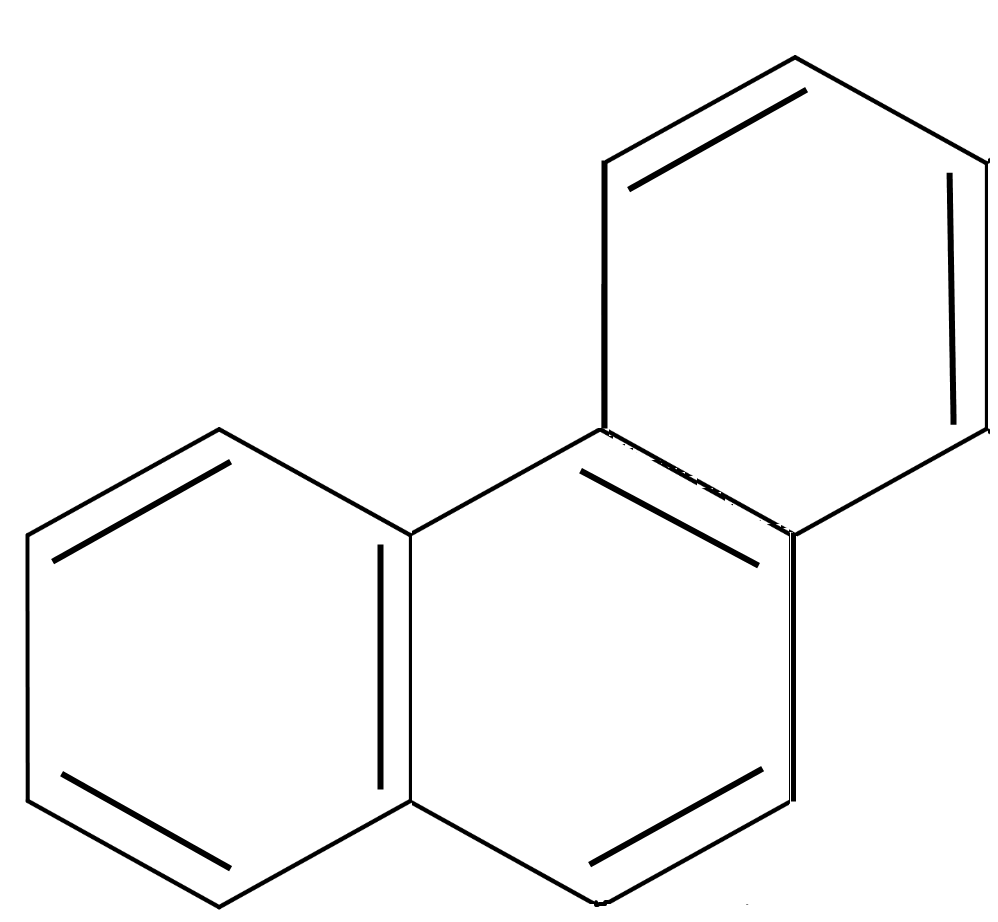
фенантрен n=3 14ē делокализовано |
||