
- •Содержание
- •Раздел 1. Аминокислоты и белки…………………………………………….4
- •Раздел 2. Углеводы …………………………………………………………..27
- •Раздел 3. Липиды……………………………………………………………..45
- •Раздел 1. Аминокислоты и белки
- •(Н2n)n- r – (соон)m
- •Реакции аминокислот в живых организмах
- •Классификация белков
- •Свойства белков
- •Распад белков
- •Основные понятия и термины раздела
- •Вопросы и задания
- •Проверьте себя (экспресс – тест)
- •Раздел 2. Углеводы
- •Классификация и строение
- •Моносахариды
- •Наиболее важные моносахариды:
- •Свойства моносахаридов
- •1. Окисление
- •2. Восстановление
- •3. Реакция со спиртами
- •4. Брожение моносахаридов
- •Производные моносахаридов
- •Биологические функции моносахаридов
- •Олигосахариды
- •Полисахариды
- •Амилоза
- •Биологические функции полисахаридов
- •Катаболизм углеводов
- •Основные понятия и термины раздела
- •Вопросы и задания
- •Проверь себя (экспресс-тест)
- •Раздел 3. Липиды
- •Классификация и функции липидов
- •Простые липиды (жиры)
- •Свойства жиров
- •Сложные липиды
- •Обмен липидов
- •Основные понятия и термины раздела
- •Вопросы и задания
- •Проверь себя (экспресс-тест)
- •Список литературы
Самарский медицинский институт «Реавиз»
Кафедра фармации
Биополимеры и их структурные
компоненты
Учебно-методическое пособие
Составитель:
старший преподаватель
кафедры фармации
Журавская О.А.
Самара 2008
УДК
Утверждено учебно-методическим советом СМИ «Реавиз»
Рецензенты: |
зав. кафедрой гуманитарных дисциплин, к.б.н.,доцент, Т.В. Шубина |
|
к.х.н.,доцент кафедры органической химии ГОУ ВПО Самарский государственный университет А.А. Данилин |
Составитель О.А. Журавская. Биополимеры и их структурные компоненты. Учебное пособие для студентов, обучающихся по специальностям «Лечебное дело», «Стоматология» очной и очно-заочной форм обучения.- Самара :СМИ «Реавиз»,2008, 64 с.
Изучение биоорганической химии и смежных с ней специальных дисциплин в медицинских учебных заведениях связано с усвоением значительного объема материала, что не всегда позволяет студентам акцентировать внимание на ключевых моментах.
Данное пособие поможет в изучении биополимеров и их структурных компонентов с учетом трудностей самостоятельного изучения предмета в заочной системе. Рекомендовано студентам, обучающимся по специальностям «Лечебное дело», «Стоматология» очной и очно-заочной форм обучения.
© СМИ «Реавиз» 2008 г.
Содержание
Раздел 1. Аминокислоты и белки…………………………………………….4
Раздел 2. Углеводы …………………………………………………………..27
Раздел 3. Липиды……………………………………………………………..45
Список литературы …………………………………………………………..58
Раздел 1. Аминокислоты и белки
Аминокислоты – гетерофункциональные соединения, в молекулах которых содержатся одновременно амино- и карбоксильные группы.
В общем виде их строение выражается формулой:
(Н2n)n- r – (соон)m
Число карбоксильных групп в молекулах аминокислот определяет их основность, наиболее важны одноосновные и двухосновные аминокислоты. В зависимости от числа аминогрупп различают моноаминокислоты и диаминокислоты.
Существуют также α-, β-, γ и т.д. аминокислоты в зависимости от положения аминогруппы по отношению к карбоксилу.
α-аминокислоты (протеиногенные аминокислоты) играют важную роль в процессах жизнедеятельности живых организмов, так как являются основой молекулы любого белка. В таблице 1 представлены аминокислоты, постоянно встречающиеся в белках. В некоторых белках встречаются редкие аминокислоты (оксопролин, γ-карбоксиглутаминовая кислота, гидроксилизин, 3,5-дийодтирозин и др.), которые являются производными тех же α-аминокислот.
Во всех (кроме глицина) природных α-аминокислотах имеются асимметрические α-углеродные атомы:
 СООН СООН
СООН СООН

 Н2N
Н Н NН2
Н2N
Н Н NН2
СН3 СН3
L (+)-аланин D (-)-аланин
Таблица 1
Протеиногенные аминокислоты
Формула |
Название |
Сокращенное обозначение
|
Н2N – СН2 – СООН
|
глицин |
гли |
Н3С – СН – СООН | NН2 |
аланин
|
ала |
Н3С \ СН – СН – СООН / | Н3С NН2
|
валин |
вал |
Н3С \ СН – СН2 – СН – СООН / | Н3С NН2
|
лейцин |
лей |
Н3С – СН2 – СН – СН – СООН | | CН3 NН2
|
изолейцин |
иле |
НООС – СН2 – СН – СООН | NН2
|
аспарагиновая кислота |
асп |
О \\ C – СН2 – СН – СООН / | Н2N NН2
|
аспарагин |
асн |
НООС – СН2 – СН2 – СН – СООН | NН2
|
глутаминовая кислота |
глу |
О \\ C – СН2 – СН2 – СН – СООН / | Н2N NН2
|
глутамин |
глн |
НО – СН2 – СН – СООН | NН2
|
серин |
сер |
Н3С – СН – СН – СООН | | ОН NН2
|
треонин |
тре |
НS – СН2 – СН – СООН | NН2 |
цистеин |
цис |
Н3С – S – СН2 – СН2 – СН – СООН | NН2
|
метионин |
мет |
Н2N – С – СН2 – СН2 – СН2 – СН – СООН || | NH NH2
|
аргинин |
арг |
Н2N – СН2 – СН2 – СН2 – СН2 – СН – СООН | NH2
|
лизин |
лиз |
N – С – СН2 – СН – СООН || || | Н С СН NН2 \ / N | Н
|
гистидин
|
гис
|
НN – СН – СООН / \ H2C CH2 \ / CН2
|
пролин |
про |
– СН2 – СН – СООН | NН2
|
фенилаланин |
фен |
| NН2
|
тирозин |
тир |
СН // \ НС С - С - СН2 - СН - СООН | || || | НС С СН NН2 \\ / \ / СН N | Н |
триптофан |
три |
Буквы L- и D- обозначают принадлежность данной аминокислоты к L- и D- стереохимическому ряду, а знаки «+» и «-» указывают направление вращения. За исходное соединение, со строением которого принято сравнивать строение аминокислоты, условно принимают L- и D- молочные кислоты; конфигурации этих кислот в свою очередь установлены по L- и D- глицериновым альдегидам.
Аминокислоты, входящие в состав белков и большинства природных соединений, относятся к L-ряду. D-формы аминокислот встречаются очень редко и входят в состав лишь некоторых антибиотиков (например, грамицидина - С).
Интересно отметить различие в физиологическом действии аминокислот L- и D-рядов. Большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда - горькие или безвкусные. Как правило, D-аминокислоты не усваиваются животными организмами.
Аминокислоты относятся к амфотерным соединениям и благодаря наличию карбоксильной группы они способны проявлять кислотные свойства, а благодаря наличию аминогруппы – присоединять протоны водорода и проявлять основные свойства. Кислотная и основная группы внутри молекулы аминокислоты взаимодействуют друг с другом и ион водорода карбоксильной группы присоединяется к атому азота аминогруппы:

Благодаря этому молекулы аминокислот представляют собой биполярные ионы, а так как противоположные и равные по величине заряды таких ионов нейтрализуют друг друга, аминокислоты являются внутренними солями. Поэтому водные растворы моноаминомонокарбоновых кислот нейтральны.
Характер диссоциации аминокислот зависит от условий среды. В кислой среде при избытке ионов водорода (рН < 7) биполярные ионы аминокислот превращаются в их аммониевые катионы; в щелочной среде при избытке гидроксильных ионов (рН > 7) биполярные ионы приходят в анионы:
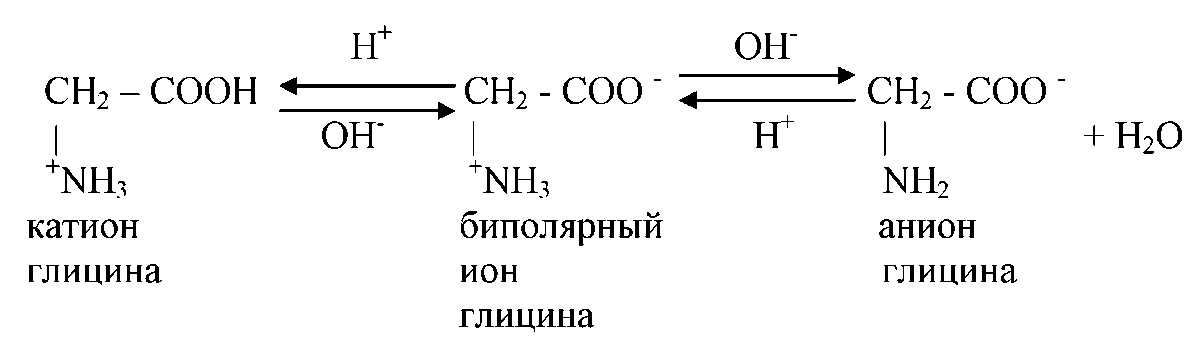
По кислотно – основным свойствам аминокислоты делят в зависимости от физико-химических свойств бокового радикала на три группы: кислые, основные и нейтральные.
К кислым относятся аминокислоты с карбоксильными группами в боковом радикале: аспарагиновая и глутаминовая кислоты. К основным – аминокислоты лизин, аргинин и гистидин, имеющие в боковом радикале группировку с основными свойствами (аминогруппа, гуанидиновая и имидазольная группы). Все остальные аминокислоты – нейтральные, так как их боковой радикал не проявляет ни кислых, ни основных свойств.
Следовательно, аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд, зависящий от рН-среды. Значение рН-среды, при котором заряд аминокислоты равен нулю, называется изоэлектрической точкой.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. Это глицин, аланин, серин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей. Для организма человека такими аминокислотами являются аргинин и гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому должны поступать с пищей. Их восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.




 НО_
_ _СН2
– СН – СООН
НО_
_ _СН2
– СН – СООН