
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
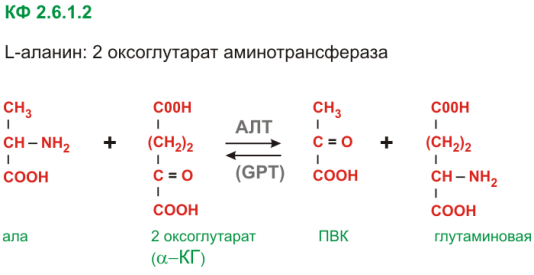
Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
Односубстратная
AB= A + B односубстратные 2-хпродуктные
A→B односубстратные однопродуктные (изомеризация)
Двусубстратные (большинство)
AB↔CD
В зависимости от последовательности
По механизму протекания
Механизм двойного замещения («пинг-понг»)
п
 оследовательный
механизм
оследовательный
механизм

М еханизмы
ферментативного действия
аланиламинотрансфеназы
еханизмы
ферментативного действия
аланиламинотрансфеназы


Общие черты активного центра:
А.ц. формируется из участков пептидной цепи и отдельных аминокислотных остатков, содержащих разные функциональные группы. Субстрат, соединяется с активным центром в нескольких точках; это обеспечивает высокую избирательность связывания (комплементарность субстрата и активного центра) и ориентацию субстрата и а.ц.) и ориентацию субстрата, необходимую для катализа реакции.
А.ц. как правило располагается в углублении (в нише, в щели) поверхности фермента. В результате субстрат, соединяясь с а.ц., оказывается не в водной среде цитозоля клетки, а в специфическом окружении функциональных групп а.ц.
В ходе присоединения субстрата и в ходе катализа происходят конформационные изменения молекулы фермента и субстрата. До взаимодействия пространственная структура структура субстрата и а.ц. лишь приблизительно соответствовали друг другу; строгая комплементарность возникает в процессе взаимодействия в результате изменений конформации (индуцированное соответствие). Конформационные изменения могут способствовать растягиванию разрываемой связи или, наоборот,сближению молекул при реакциях синтеза и тем самым вносят вклад в ускорение реакции.
Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
Кинетика- учение о скоростях.
Скорость ферментативных реакций определяется посредством введения прореагировавших веществ за определенное время при определенных условиях. Измеряют по убыли субстрата S или приросту продукта P за единицу времени. Зависит от активности фермента. Активность фермента выражается в ед. ферментативной активности. Каталитическая активность фермента катализирует 1 моль субстрата за 1 сек. Моль/сек (кат). Хмкмоль/сек*л – Х мкмлоь субстрата, преобразованные в 1 л. За 1 сек. E=ME+мкмоль/мин.
Активность ЛДГ. 120 U/L 1мкат/л=60 U/L Xмкат/л= 120 U/L
Удельная активность фермента

Молекулярная активность фермента.
В образце содержится 0,0014 мкмоль ацетилхолинэсткразы, активность 420 мкмоль/сек. Мол акт = (420 МКМОЛЬ/МИН)/ 0,0014мкмоль= 300000мин-1. Указывает сколько молекул субстрата превращается 1 молекулой фермента за 1 мин. Измерение скорости ферм. Акт по убыли субстрата
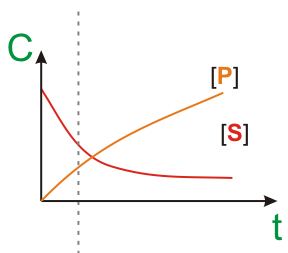
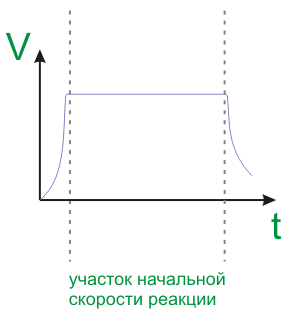
Порядок реакции определяется характером ее зависимости от концентарции субстрата.
ПОРЯДОК РЕАКЦИИ по данному в-ву, показатель степени при концентрации этого в-ва в кинетич.. ур-нии р-ции. Согласно действующих масс закону, скорость у простой (одностадийной) р-ции между в-вами А и В.

