
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
(E – фермент, AB –субстраты, CD – продукты)
Типы:1)односубстратные:а)односубстратная-двухпродуктная:АВ (1 молекула) А+В(2 продукта),б)односубстратная – однопродуктная(как пример,реакции изомеризации):А В.
2)двухсубстратные(до 70% всех реакций): А+В С+D (могут быть обратимыми (->) или необратимыми ( <=>,участвует другой фермент или этот же при накоплении продукта).
Механизмы 2-х субстратных реакций: делятся в зависимости от последовательности присоединения субстрата в ходе протекания реакции на: 1)механизм двойного замещения(пинг-понг механизм):E+A(входит) <=>(EA<=>E’C)(C выходит)->E’+B(B входит) <=>(E’B<=>ED)(D выходит) ->E. По типу механизма двойного замещения идут реакции периминирования – открыты Браунштейном – 1927г.
2)последовательный механизм:E+A(A входит)<=>EA+B(B входит) <=>(EAB<=>ECD)->ED(C выходит) ->E(D выходит).Таким образом оба субстрата должны соединиться и образовать тройной комплекс.
По типу последовательного механизма работают надзависимые дегидрогеназы,гликозилтрансферазы,креатинкиназа.
Реакция периминирования на примере пиридоксаль-зависимого фермента аланинаминотрансферазы (L-аланин:2-оксоглутарат аминотрансфераза,АЛТ,ALT,АлАТ): Аланинаминотрансфераза катализирует перенос аминогруппы с аланина на 2-оксоглутарат:
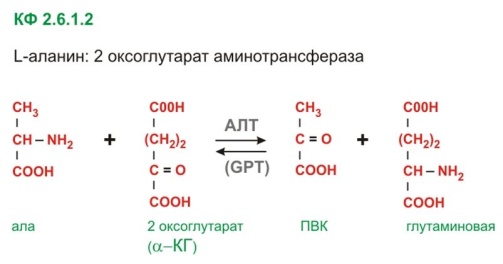
Коферментом аминотрансфераз служит пиридоксальфосфат – производное пиридоксина(витамина В6).Кофермент присоединяется ковалентной связью к группе лизина.Между белком и перидоксальфосфатом есть ионные взаимодействия.
Реакции периминирования проходят в две стадии(полуреакции).Если к раствору фермента добавить только один из двух субстратов – аланин,то произойдет первая полуреакция.Аминогруппа аланина присоединяется к углероду альдаминной группы фермента: альдиминная связь между коферментом и белком заменяется на альдаминную связь между коферментом и аланином.В целом в результате этой полуреакции пиридоксальдиминфосфат превращается в пиридоксамин,а аланин – в пировиноградную кислоту:
Пиридоксальдиминфосфат-фермент (E) + аланин (А) + H2O <=> пиридоксамин фосфат-фермент + пируват (С)
При наличии второго субстрата – 2-оксоглутаровой кислоты – произойдет вторая полуреакция:
Пиридоксоаминфосфат-фермент (E’) + 2-оксоглутарат (В) <=> Пиридоксальдиминфосфат-фермент (E) + Глутамат (D)+ H2O.
В этой полуреакции фермент переходит в начальную форму (альдиминную) и образуется второй продукт реакции – глутамат. Таким образом, суммарный результат двух полуреакций – перенос аминогруппы с аланина на 2-оксоглутарат.
54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
I Кетогенные а\к
Лейцин, лизин – только кетогенные, остальные смешанные.
Лейцин, изолейцин, триптофан -> ацетил коа -> ацетоацетил коа -> Кетоновые тела
Лизин, триптофан, тирозин, фенилаланин напрямую образуют ацетоацетил Коа-> Кетоновые тела

Оксалоацетат, фумарт, СукцинилКоА и α-кетоглуторат интермедиаты цикла Кребса
15. Способы количественного определения белка. Методы определения общего белка сыворотки крови и мочи.
Спектрометрия - свет поглощается за счет присутствия в составе белка ароматических АК. Используется для определения концентрации индивидуального белка, без примесей (особенно, нуклеиновых кислот). Формула Калькара: С (г/л) = 1,55А(280) – 0,75А(260), где А – абсорбция
Колориметрия – основана на способности белков образовывать цветные комплексы с реактивами, имеющими хромофорные свойства (хромофор – молекула или часть молекулы, которая может быть возбуждена посредством поглощения света: -N=N; =C=; -N=S; -N=O; -C=C- и т.д.)
Биуретовый метод – белок в ЩЕЛОЧНОЙ СРЕДЕ обр. с Cu2+ соединение, окраш. в сине-фиолетовый цвет: «медно-белковый комплекс». Такая реакция предполагает, что белки имеют не меньше 3х пептидных связей. Для стабилизации реагента (предотвращение ОВР) вводят KI.
Метод Лоури (годится для белков в естественных средах. имеющих примесные соединения).
Взаимодействие аминогруппы с различными реагентами (напр., с тринитробензолсульфокислотой).
Методы, основанные на специфической сорбции некоторых красителей поверхностью белковой молекулы. Красители фиксируются за счет ионных связей (предпочтит. кислое значение). Могут быть и ковалентные варианты взаимодействия.
Амидовый черный
Кумасси бриллиантовый синий G250 или R280
Понсо S (ярко-красный)
Бромфеноловый синий
Способы количественного определения белка в сыворотке крови и моче.
Азтометрический метод – определение белкового азота: выжигание органического соединения, а затем расчет остаточного азота. Метод относительно точный.
Гравиметрический – работа с осадками
Центрифугирование (многократное)
Отмывание (многократное)
Рефрактометр – определение уровня белка по показателю преломления (если сыворотка относительно здорового человека; гемолизированная сыворотка = разрушенные эритроциты, хилёзная сыворотка = избыток жиров, эктеричная св-ка = гепатиты – не подходят!)
Метод определения по плотности (удельному весу)
Спектрофотометрический метод не подходит из-за избытка примесей в исслед. образце
Колориметрический метод – качественное определение, основанное на способности белков к образованию цветных комплексов.
Турбидиметрический метод – измерение помутнения после осаждения трихлоруксусной кислотой (денатурация+осаждение). Не очень точный. Использ. для количеств. определения белка в моче.
Методы, основанные на специфичности сорбции некоторых красителей на поверхности белковой молекулы.
Поляриметрический (сухая химия «на полосках»)
