
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
13. Последовательность и методы изучения первичной и вторичной структуры белка
Последовательность изучения структуры белка
Анализ первичной структуры
Определение АК состава белка
Горячий кислотный гидролиз: 6М HCl температура 110, 24 часа в стеклянной ампуле –> аминокислотный гидролизат
АК-ный анализатор. Хроматографическая колонка разделяет кислые и основные АК вымыванием. Количество АК учитывается с помощью нингидриновой реакции или с помощью флюорескатина
Определение АК-ной последовательности. Порядок изучения первичной структуры.
Определение числа протомеров в молекуле белка. Заключение о числе протомеров делают, подсчитывая число NH2-концевых остатков, приходящихся на одну молекулу белка.
Разрушение S-S связей и проведение селективного гидролиза, позволяющее получить фрагменты полипептидной цепи:
- S-S разрушение помощью муравьиной кислоты
- Селективный гидролиз – гидролитическое расщепление полипептидных связей по определенным положениям последов-ти АК в протомере
Селективные протомеры
Хемотрипсин - разрушает связи, образованные фенильными АК (ароматическими)
Трипсин - режет по аргинину
Бромициан - по карбонильной группе в метианине.
Бромсукцининимид – по карбонильной группе триптофана
Гидроксиламин – разр.связь между аспарагином и глицином
Для селективного гидролиза исп. не менее двух агентов
Установление порядка чередования
С N- конца: Реакция Сенджера с 2,4 - динитрофторбензолом
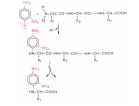
+ свободные АК
Реакция с дансилхлоридом

Реакция Эдмана с фенилизотиоцианатом (для короткого полипептида)

Метод Акабори (расщепление связей с помощью гидразина при 100 ͦ в безводной среде)
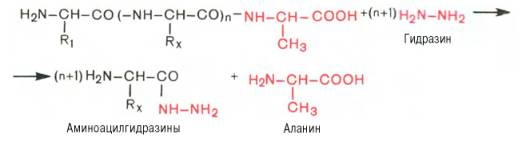
Аминопептидазы отщепляют крайнюю концевую АК с N-конца
Карбоксипептидаза - идентификация с С-конца
Цветные реакции на АК
Ксантопротеиновая реакция - выполняется на циклические АК в резкокислой среде. Если продукт желтого цвета – есть цикл. АК
Реакция Фолля – серосодержащие АК (красный продукт+)
Реакция Милона на тирозин в HNO3 (пурпурный цвет+)
Реакция Паули на ароматические АК и гистидин
Реакция Сакагучи на аргинин (оранжево-красный+)
Определение проядка следования фрагментов в ПП цепи
Логический вывод по результатам не менее 2 исследований
Спектрометры
По последовательности нуклеотидов, кодирующих этот белок (учитывать интронные вставки!)
Анализ конформации белков
Рентгеноструктурный анализ – из белковой структуры изготавливают кристаллич. структуру, выращенную искусственно
УФ –спектроскопия (соотношение показаний спектра)
Флюоресцентная спектроскопия (тирозин, триптофан, фенилаланин дают флюоресц. явления)
ЯМР – спекроскопия – ввод радиоизотопов, кот. могут иметь магнитные ядра, поглощ. в однородном магнитном поле энергию строго определенной резонансной частоты
Расчетные методы (молекулярная динамика и механика) – рассчитывают энергию каждого атома белк. молекулы и затем располагают их в пространстве.
Дисперсия оптического вращения. Для общего описания β-складачатых структур и α-конформационных спиралей. По-разному вращается плоскополяризованный свет; по-разному поглощается циркулярнополяризованный свет. Вектор направления электрич. поля для всех фотонов светового пучка лежит в одной плоскости – плоскополяризованный свет. Циркулярнополяриз. свет – вектор напряженности описывает спираль.
Инфракрасная спектроскопия (Для общего описания β-складачатых структур и α-конформационных спиралей) – белок растягивают на пленках, свет падает вдоль и поперек этой плёнки -> характеристика растянутой молекулы – архитектоника водородных связей.
14. Использование фотометрического анализа в биохимии. Этапы подбора оптимальных условий для проведения фотометрического анализа.
Фотометрический анализ
Спектроскопия
Абсорбционная – длина волны, при которой происходит поглощение, и степень поглощения зависят от структуры молекулы и от её окружения. Основана на измерении уменьшения интенсивности излучения, прошедшего через исслед. раствор. Величина поглощения светового потока прямо пропорциональна числу частиц поглощенного вещества. Чем больше оптическая плотность, тем меньше пропускание, тем больше абсорбция.
Атомно-абсорбционная
Растворов
Взвесей
Нефелометрия
Турбидиометрия (измерение ослабления света при прохождении через раствор)
Эмиссионная
Атомно-эмиссионная
Флуориметрия
Исследуемое соединение переводят в окрашенное или бесцветное, но поглощающее свет состояние, после чего кол-во продукта реакции определяют по поглощению света.
Окраска раствора обусл. неравномерным поглощением отдельных участков спектра видимого света. При столкновении световой волны с молекулой, волна может рассеиваться (уходить в сторону) или поглощаться (её энергия передается молекуле)
Фотометр – прибор, предназначенный для измерения прозрачности веществ для световых волн определенной длины.
Фотоэлектроколориметр – измеряет только окрашенные растворы.
Спектрометр – измеряет и окрашенные и неокраш. растворы. Определяет меньшие концентрации с большой точностью.
Этапы подбора оптимальных условий для проведения фотометр. анализа
Выбор длины волны
Толщина рабочего слоя = длина оптического пути
Стандартный раствор – длина волны задается самостоятельно
Калибровочный график – выбрать тот оптический путь, для кот. построен график.
Выбор раствора сравнения
Дистилл. вода
Контрольные агенты
Выбор оптимальных временных параметров фотометрии
Выбор построения калибровочного графика
