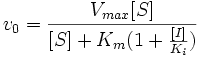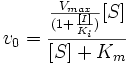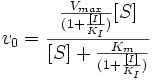- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
Гликгенолиз.
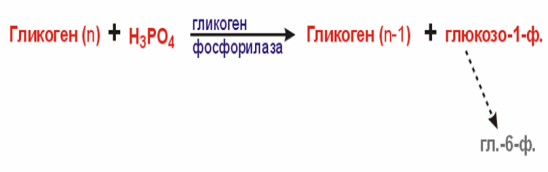
В результате фосфоролирования происходит разрыв гликозидных связей. Гликогенфосфорилаза - димерная молекула.
Вопрос№25 Константа Михаэлиса.
Михаэлиса
константа,
один из важнейших параметров кинетики
ферментативных реакций, введенный
немецкими учеными Л. Михаэлисом (L.
Michaelis) и М. Ментен в 1913; характеризует
зависимость скорости ферментативного
процесса от концентрации субстрата.
Согласно теории Михаэлиса — Ментен,
первым этапом любого ферментативного
процесса является обратимая реакция
между ферментом (Е)
и субстратом (), приводящая к образованию
промежуточного фермент-субстратного
комплекса (ES),
который затем подвергается практически
необратимому расщеплению на продукт
реакции (Р)
и исходный фермент:
 Реакции
образования и распада комплекса ES
характеризуются
константами скорости k1,
k-1,
k2.
Если концентрация субстрата значительно
превышает концентрацию фермента (S)
>> (E))
и, следовательно, концентрация ES
становится постоянной, скорость
ферментативной реакции (u) выражается
уравнением:
Реакции
образования и распада комплекса ES
характеризуются
константами скорости k1,
k-1,
k2.
Если концентрация субстрата значительно
превышает концентрацию фермента (S)
>> (E))
и, следовательно, концентрация ES
становится постоянной, скорость
ферментативной реакции (u) выражается
уравнением:
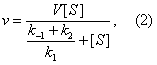 где
— максимальная скорость реакции,
достигаемая при полном насыщении
фермента субстратом. Соотношение
констант скорости
где
— максимальная скорость реакции,
достигаемая при полном насыщении
фермента субстратом. Соотношение
констант скорости
![]() также
является константой (Кm),
получившей название Михаэлиса
константа
Подставляя в уравнение (2) Михаэлиса
константа,
получаем уравнение Михаэлиса —
Ментен:
также
является константой (Кm),
получившей название Михаэлиса
константа
Подставляя в уравнение (2) Михаэлиса
константа,
получаем уравнение Михаэлиса —
Ментен:
![]() Из
уравнения (3) следует, что Михаэлиса
константа
численно равна концентрации субстрата,
при которой скорость реакции составляет
половину максимально возможной (см.
рис.).
В ряде случаев, когда величина k1
мала и ею можно пренебречь, Михаэлиса
константа
становится равной
Из
уравнения (3) следует, что Михаэлиса
константа
численно равна концентрации субстрата,
при которой скорость реакции составляет
половину максимально возможной (см.
рис.).
В ряде случаев, когда величина k1
мала и ею можно пренебречь, Михаэлиса
константа
становится равной
![]() и
может служить мерой сродства субстрата
к ферменту. Михаэлиса
константа
имеет размерность концентрации.
Практически величину Михаэлиса
константа
находят различными графическими
методами, исследуя зависимость скорости
ферментативной реакции от концентрации
субстрата.
и
может служить мерой сродства субстрата
к ферменту. Михаэлиса
константа
имеет размерность концентрации.
Практически величину Михаэлиса
константа
находят различными графическими
методами, исследуя зависимость скорости
ферментативной реакции от концентрации
субстрата.
Вопрос№26Обратимые и необратимые ингибиторы ферментов. Характерные черты конкурентного, неконкурентного и бесконкурентного ингибирования.
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы. Обратимые делятся на конкурентные, неконкурентные, бесконкурентные.
Обратимое ингибирование
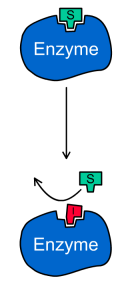
В
 этом случае ингибитор связывается в
активном
центре
фермента и конкурирует за него с
субстратом.
Таким образом, конкурентный ингибитор
не связывается с фермент-субстратным
комплексом (ES на рис.1), то есть константа
диссоциации Ki'
>> 1.
этом случае ингибитор связывается в
активном
центре
фермента и конкурирует за него с
субстратом.
Таким образом, конкурентный ингибитор
не связывается с фермент-субстратным
комплексом (ES на рис.1), то есть константа
диссоциации Ki'
>> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.Схема конкурентного
ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах Лайнуивера-Берка (зависимость 1/v0 от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование
П
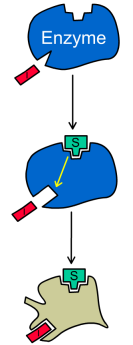 ри
бесконкурентном ингибировании ингибитор
связывается только с фермент-субстратным
комплексом, но не со свободным ферментом.
Субстрат, связываясь с ферментом,
изменяет его конформацию, что делает
возможным связывание с ингибитором.
Ингибитор, в свою очередь, так меняет
конформацию фермента, что катализ
становится невозможным.
ри
бесконкурентном ингибировании ингибитор
связывается только с фермент-субстратным
комплексом, но не со свободным ферментом.
Субстрат, связываясь с ферментом,
изменяет его конформацию, что делает
возможным связывание с ингибитором.
Ингибитор, в свою очередь, так меняет
конформацию фермента, что катализ
становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
|
|
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций субстрата получаем семейство параллельных прямых.