
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.

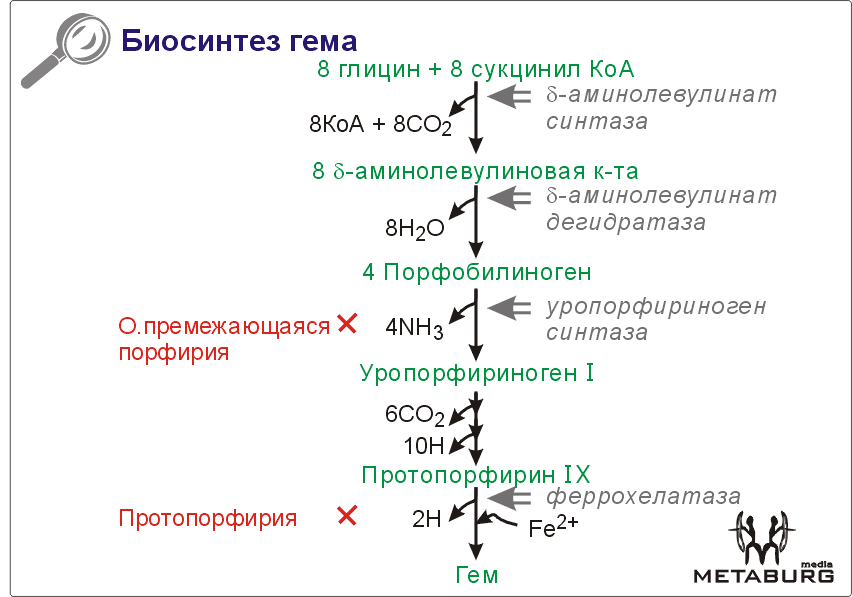
Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз .Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма.
Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА (на схеме наверху), промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза)] является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи.
После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо.
На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой . Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза .Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I.
Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп .Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные Модификация боковых цепей заканчивается образованием протопорфириногена IX.
На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов .В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа .Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно .
КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
При физиологических условиях в организме взрослого человека разрушается 1--2108 эритроцитов в час. Таким образом, в течение суток у человека массой 70 кг обновляется приблизительно 6 г гемоглобина. При разрушении гемоглобина его белковая часть (глобин) может быть использована как таковая или после гидролиза в форме составляющих ее аминокислот; железо гема включается в общий пул железа и также снова используется. Вместе с тем свободная от железа порфириновая часть гема обязательно деградирует; это в основном происходит в ретикулоэндотелиальных клетках печени, селезенки и костного мозга. Катаболизм гема, освобожденного из любых гемовых белков, осуществляется в микросомальной фракции ретикулоэндотелиальных клеток сложной ферментной системой - гем-оксигеназой. К моменту поступления гема из гемовых белков в гем-оксигеназную систему железо обычно окисляется в ферри-форму (гем превращается в гемин); гемин может легко связываться с альбумином с образованием метгемальбумина. Гем-оксигеназная система индуцируется субстратом. Она локализована около микросомальной системы транспорта электронов. Гемин восстанавливается в ферро-форму с помощью NADPH; далее при участии NADPH кислород присоединяется к а-метенильному мостику между пиррольными кольцами I и II. Ферро-форма железа снова окисляется в ферри-форму. При последующем присоединении кислорода происходит освобождение ферри-иона, выделение молекулы оксида углерода (II) и образование в результате раскрытия тетрапиррольного кольца эквимолярного количества биливердина IX - . В этой реакции сам гем участвует в роли катализатора. Дальнейшей метаболизм билирубина в основном происходит в печени. Он складывается из трех процессов: 1) поглощение билирубина паренхимальными клетками печени; 2) конъюгация билирубина в гладком эндоплазматическом ретикулуме и 3) секреция билирубина из эндоплазматического ретикулума в желчь. Рассмотрим каждый из процессов в отдельности.
Поглощение билирубина печенью
Билирубин слаборастворим в плазме и воде; в плазме он специфически связывается с альбумином. Каждая молекула альбумина имеет, по-видимому, два центра связывания билирубина -- высоко- и низкоаффинный. В 100 мл плазмы может содержаться 25 мг билирубина, прочно связанного с альбумином по его высокоаффинному центру. «Избыточный» билирубин связывается с альбумином менее прочно; он легко отделяется от альбумина, диффундируя в ткани. Ряд соединений -- антибиотики и некоторые другие лекарственные вещества -- конкурируют с билирубином за высокоаффинный центр альбумина. Эти соединения могут вытеснять билирубин из комплекса с альбумином и проявляют значительное клиническое действие.
В печени происходит переход билирубина от альбумина на синусоидальную поверхность гепатоцитов при участии насыщаемой системы переноса, в функционировании которой участвует некий переносчик. Эта система облегченного транспорта имеет очень большую емкость и даже при патологических условиях не лимитирует скорость метаболизма билирубина. Поскольку система облегченного транспорта обеспечивает установление равновесия билирубина по обе стороны синусоидальной мембраны гепатоцита, поглощение билирубина зависит от его потребления в последующих метаболических процессах.

Конъюгация билирубина
В печени к билирубину присоединяются полярные группы и он переходит в водорастворимую форму, которая секретируется в желчь. Процесс, обеспечивающий повышение растворимости в воде (т. е. повышение полярности) билирубина, называется конъюгацией. Этот процесс, по крайней мере на начальных стадиях, протекает в гладком эндоплазматическом ретикулуме и осуществляется специальным набором ферментов. У млекопитающих билирубин секретируется в желчь преимущественно в форме билирубиндиглюкуронида
Секреция билирубина в желчь
Секреция конъюгированного билирубина в желчь идет против весьма высокого градиента концентрации и должна осуществляться с помощью механизма активного транспорта. Активный транспорт является, вероятно, скорость-лимитирующей стадией всего процесса метаболизма билирубина в печени. Транспорт конъюгированного билирубина из печени в желчь индуцируется теми же лекарствами, которые способны индуцировать конъюгацию билирубина. Таким образом, системы конъюгации билирубина и его вывода из гепатоцитов работают как единый функционально координируемый механизм.
При физиологических условиях практически весь секретируемый в желчь билирубин (свыше 97%) находится в конъюгированной форме. Только после светотерапии заметные количества неконъюгированного билирубина могут быть обнаружены в желчи.
В печени имеются многочисленные системы секреции в желчь природных и синтетических лекарственных соединений после их метаболизма. Некоторые из этих систем используются также билиру-биндиглюкуронидами.
МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
После того как билирубин достигает области подвздошной и толстой кишок, глюкурониды гидролизуются специфическими бактериальными ферментами (р-глюкуронидазами); далее кишечная микрофлора восстанавливает пигмент с образованием группы бесцветных тетрапиррольных соединений, называемых уробилиногенами.
В подвздошной и толстой кишках небольшая часть уробилиногенов снова всасывается и попадает в печень, т.е. осуществляется внутрипеченочный уробилиногеновый цикл. При патологических состояниях, например при накоплении избыточных количеств желчных пигментов или при заболеваниях печени, нарушающих работу внутрипеченочного цикла, уробилиноген может экскретироваться с мочой.
В норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке под действием кишечной микрофлоры, окисляется в уробилины (окрашенные соединения) и удаляется с фекалиями Наблюдаемое потемнение последних на воздухе является следствием окисления оставшихся уробилиногенов в уробилины.
