
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
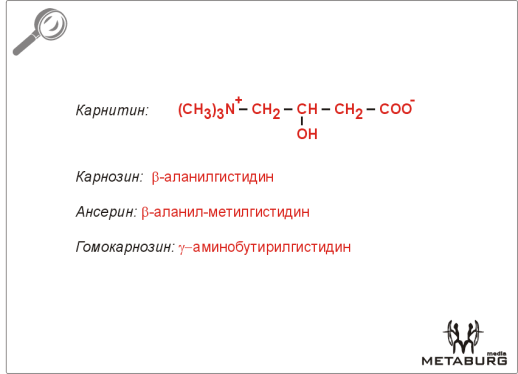
58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
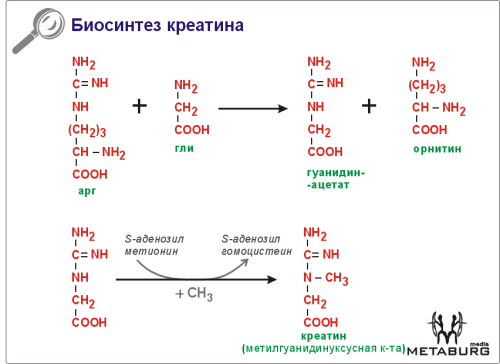

Креатин. Запасённый в ваших мышцах креатин, является очень важным поставщиком фосфатных групп, используемых при синтезе АТФ (Аденозинтрифосфорной кислоты). АТФ обеспечивает клетки мышц энергией, необходимой для мускульных сокращений. Кроме этого, креатин позволяет увеличивать объем клетки, выступая ускорителем синтеза белков, из которых, собственно, и состоят мускулы.
Креатинфосфат - продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатин гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина ~ -43 кДж/моль, в то время как при гидролизе АТФ до АДФ ~ -30 кДж/моль.
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
креатинфосфат + АДФ ⇔ креатин + АТФ
Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается в вправо, что ведёт к восстанавлению нормальной концентрации АТФ.Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается.В тканях креатинфосфат подвергается самопроизвольноми неферментативному гидролизу с циклизацией в креатинин, выводящийся с мочой, уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком.Креатинфосфат является одним из фосфагенов - N-фосфорилированных производных гуанидина, являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих беспозвоночных (например, насекомых) роль фосфагена играет аргининфосфорная кислота, у некоторых кольчатых червей - N-фосфоломбрицин.
Креатинин – конечный продукт обмена белков. Креатинин образуется в печени и затем выделяется в кровь. Креатинин участвует в энергетическом обмене мышечной и других тканей. Из организма креатинин выводится почками с мочой, поэтому креатинин – важный показатель деятельности почек. Содержание креатинина в крови зависит от объема мышечной массы, поэтому, для мужчин норма креатинина, как правило, выше, чем у женщин. Так как объем мышечной ткани быстро не меняется, уровень креатинина в крови — величина достаточно постоянная.
Карнитин -органическая азотсодержащая кислота. Находится главным образом в мышцах животных. Участвует в процессе окисления жирных кислот, перенося их остатки через внутреннюю мембрану митохондрий. Фактор роста (витамин) некоторых насекомых. Карнитин- 7-триметиламино-5-оксимасляная кислота. Присутствует в животных тканях, в значит, кол-вах — в мышцах, а также в бактериях и растениях. Стимулирует окисление жирных к-т в митохондриях: в присутствии специфич. цитоплазматич. фермента К. переносит остатки жирных к-т (ацилы) из цитоплазмы клеток в митохондрии (через митохондриальные мембраны), где в результате обратного переноса ацилов на кофермент А образуются ацилы ко-фермента А, подвергающиеся в митохондриях окислению. В организме млекопитающих К. синтезируется в достаточном кол-ве из лизина. Для нек-рых насекомых (напр., мучного червя Тепеbrio molitor) К.— фактор роста, т. к. они не синтезируют его; на этом основании К. относят к витаминам (витамин В2).
Ансерин- природный дипептид, обеспечивающий сопряженность процессов окисления и фосфорилирования в мышечной ткани.
