
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
Элонгация

Схема РНК-связывающих участков рибосомы. Буквами обозначены участки связывания тРНК. А — аминоацил-тРНК-связывающий участок, Р — пептидил-тРНК-связывающий участок, Е — участок отсоединения тРНК от рибосомы (англ. exit).
В процессе наращивания полипептидной цепи принимают участие два белковых фактора элонгации. Первый (EF1a у эукариот, EF-Tu — у прокариот) переносит заряженную тРНК в А (аминоацил)-сайт рибосомы. После формирования пептидной связи, что катализируется рРНК, и переноса связанной с тРНК пептида в из Р-сайта в А-сайт второй белок (EF2 у эукариот, EF-G — у прокариот) катализирует перемещение рибосомы на один триплет. Таким образом петидил-тРНК оказывается вновь в Р-сайте, а «пустая» тРНК в Р-сайте — в Е-сайте. Цикл элонгации завершается, когда новая тРНК с антикодоном, подходящим к кодону в А-сайте доставлена EF1a (или EF-Tu).
51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
Азотистый баланс-разница между кол-м N, поступающего с пищей, и кол-м выделяемого N (главным образом в составе мочевины). Азотистое равновесие-выделяемый азот=поглощаемому. Положительный азотистый баланс-в период роста и в период выздоровления после истощающих заболеваниях выводится азота меньше. При старении, голодании и в течение истощающих заболеваний N выводится больше, чем, поступает, -отрицательный азотистый баланс. При обычном питании энергетическая роль а.к. Невелика, однако может быть существенной при преимущественно белковом питании, а также при голодании; используются а.к. Получаемые при распаде собственных белков. Фонд свободных а.к. Организма составляет около 30г. Содержание а.к. В крови равно 35-65мг/дл. Подавляющая часть а.к. Организма входит в состав белков. Источниками свободных а.к. служат пищевые белки, белки собственных тканей, а также синтез а.к. из углеводов.
Общие пути распада а.к.
1.Переаминирование(двусубстратная реакция, идет по системе пинг-понг)
2.Дезаминирование.
3.Декарбоксилирование.
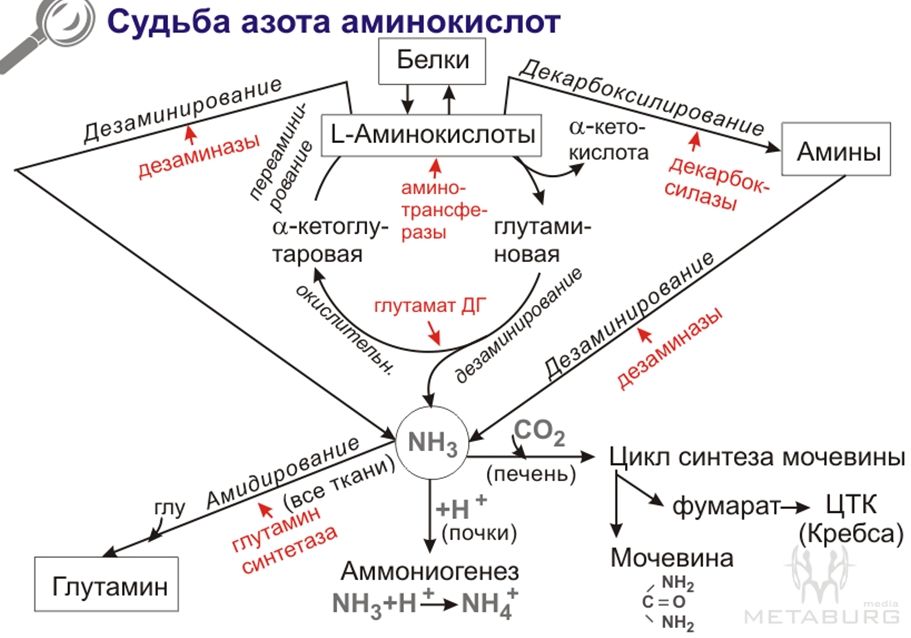
53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
Болезни, связ с паталогиями в синтезе мочеывины:
Тип I. Гипераммониемия. Активность карбомоилфосфатсинтетазы1
Тип II. Гипераммониемия Карбомоилфосфат накапл, но не прох р-я с обр цитрулина
Цитрулинемия. Многоцитрулина в крови и моче.
Аргининосукцинатная ацидемия
Гипераргининемия. Много аргинина.
1и2 самые тяжелые.
Методы опроеделения конц белка в крови и моче
Спектрофотометрия. Основана на поглощении в УФ секторне (до 280 нм) Метод очень чувствит елеен. Пригоден для очищен белка без примесей. Т.е. для научн исследования.
Колорометрич метод. – осн на СП-ти белков обр цветные компл с реактивами. Примеры: Биуретов метод (чувствит 1 мг\мл) Метод Лоури (10мкг\мл) Вз-е аминогрупп с различн реагентами
Метод основанный на специфической нек красителей пов-ю белков мол. Сорбция обесп за счет электростат вз-ия и ков связей. Амидо-черный, Кумасси бриллиант синий, Понсо S, бромфеноловый синий.

