
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
Ферменты в медицине используются в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) целей. Кроме того ферменты используются в качестве специфических реактивов для определения ряда в-в.
При лечении желудочных заболеваний , сопровождающихся снижением содержания пепсина в желудочном соке, для улучшения пищеварения назначают препараты пепсина (заместительная терапия). Протеолитические ферменты применяют при первичной обработке ран: гидролизуя белки разрушенных кл-к, ферменты способствуют очищению ран и уменьшении воспалительных явлений. Нуклеазы (катализ разрушения нуклеиновых кислот) используются при лечении вирусных заболеваний. Некоторые протеолитические ферменты применяют для предотвращения или лечения тромбов, закупорки кр. сосудов сгустками крови. Аспарагиназу применяют для лечения некоторых форм лейкозов. Аспарагин в лейкозных к-ах не синтезируется, и к-ки получают его из плазмы крови. Если ввести в кровь больного аспарагиназу, то аспарагин в плазме крови разрушается и синтез белков в лейкозных к-ах прекращается – к-ки гибнут.
С помощью фермента можно определить его субстрат в смеси, содержащей множество др. в-в. Этим методом измеряют содержание глюкозы, мочевины, моч. к-ты, мол. к-ты, креатинина, холестерина и др.
Энзимодиагностика заключается в постановке диагноза заболевания на основе определения активности ферментов в биол. жидкостях человека. При повреждении к-к в крови увеличивается концентрация внутрикл. ферментов поврежденной к-ки.
32. Строение и функции нуклеотидов в живых организмах.
Функции нуклеотидов:
Мононуклеотиды – структурные компоненты нуклеиновых кислот.
Входят в состав коферментов (НАД, НАДФ,ФАД, КоА). Нуклеотидтрифосфаты могут быть в роли коферментовв реакциях переноса моносахаридных остатков (ГТФ, УТФ)
Высокоэнергетические соединения – нуклеотидтрифосфаты.
Циклические нуклеотиды являются посредниками, вторичными мессенджерами при передаче сигналов внутрь к-ки.
Нуклеотид: азотистое основание + пентоза + остаток фосфатной группы.



33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
Образование пиримидиновых нуклеотидов de novo. Пиримидиновое кольцо синтезируется из простых предшественников: глутамина, СО2, аспарагиновой к-ты, затем связывается с рибозо-5-фосфатом, полученным от ФРДФ. Процесс протекает в цитозоле к-ки. Карбомоилфосфат есть в цитоплазме почти всех к-к. Карбомоилфосфатсинтетаза 2 есть во всех тканях, карбомоилфосфат синтетаза 1работает с аммиаком, есть только в митохондриях печени. Синтез ключевого пиримидинового нуклеотида – УМФ идет с участием 3 ферментов.

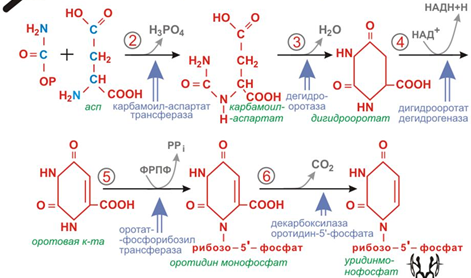
1-3 катализируются одним ферментом, который является полифункциональным. Имеет 3 субъединицы с 3 специфическими активными центрами: карбомоилфосфатсинтетаза2, карбомоиласпартат трансфераза, дегидрооротаза.
4 отдельный фермент
5-6 катализирются одним ферментом.
УМФ+АТФ→УДФ+АДФ (киназа)
УДФ+АТФ→УТФ+АДФ
УТФ+глутамин→ЦТФ+глутамат(цитидинтрифосфат)
Путь спасения., «запасной» путь синтеза из прежних оснований.
Урацил+рибозо-1-фосфат→уридин +Н3РО4 (нуклеозидфосфорилаза)
Уридин+АТФ→УМФ+АДФ (уридинкиназа)
Катаболизм.

