
- •1.Структура и функции мембран.Виды трансмембранного переноса.Механизм работыNa-k-Атф-азы.
- •2.Функции и свойства белковых и липидных компонентов мембран. Белки-рецепторы.Транспортная передача сигналов в клетку.
- •3.Структура,классификация аминокислот по строению радикалов.
- •4.) Структура аминокислот. Заменимые и незаменимые аминокислоты, кетогенные и гликогенные.
- •5.) Физико-химические свойства аминокислот.
- •6.)Структура и функции белков.
- •8.Структура белков. Связи характерные для третичной и четвертичной структуры
- •9. Физико-химические свойства белков
- •11.Методы выделения и очистки белков.
- •12.Оценка степени очистки и Определение Mr.
- •Вопрос 22. Типы ферментативных реакций. Механизмы 2-хсубстратаых реакций. Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •Вопрос 23. Кинетика ферментативных реакций. Единицы активности. Измерения скорости реакции. Порядок реакции.
- •Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
- •31. Применение ферментов в медицине. Способы определения активности ферментов в сыворотке крови.
- •32. Строение и функции нуклеотидов в живых организмах.
- •33. Биосинтез и катаболизм пиримидиновых нуклеотидав. Регуляция биосинтеза.
- •3 7. Строение и физико-химические свойства днк. Методы исследования структуры днк
- •38. Строение и функции рнк.
- •39.Репликация днк у прокариот. Свойства днк-полимераз прокариот. Лекарственные препараты, тормозящие репликацию.
- •40. Репликация днк у эукариот. Свойства днк-полимераз эукариот. Репликация днк и клеточный цикл.
- •41.Этапы процесса транскрипции. Днк-зависимые рнк-полимеразы эукариот и прокариот.
- •42.Инициация элонгации и терминация транскрипции у эу и про:
- •43. Процессинг у прокариот
- •44. Процессинг у эу:
- •45. Активирование аминокислот и необходимые компоненты этапов трансляции
- •46.Процесс трансляции и прокариот
- •47.Процесс трансляции у эукариот
- •Инициация трансляции
- •Механизм инициации трансляции у прокариот
- •Элонгация
- •51. Источники и пути расходования ак в организме. Азотистый баланс. Общая схема потока азота при катаболизме ак.
- •53. Цикл синтеза мочевины. Болезни, вызванные генетическими дефектами ферментов цнс. Методы определения концентрации мочевины в крови и моче.
- •Вопрос 60
- •Вопрос 61
- •Вопрос 62
- •64. Механизм сопряжения окисления и фосфорилирования.
- •65.Основной энергетический обмен и теплопродукция. Потоки важнейших метаболитов, поступающих в митохондрии и выходящих из них.
- •66.Токсичность активных форм кислорода (афк). Свободные радикалы. Перекисное окисление. Окислительный стресс. Механизмы антиоксидантной защиты.
- •70. Катаболизм глюкозы в условиях недостатка кислорода (анаэробный)
- •71. Катаболизм глюкозы в условиях недостатка кислорода (аэробный)
- •772.Глюконеогенез: локализация, функции, регуляция глюконеогенеза.
- •57. Биологически активные производные тирозина. Локализация синтеза и их роль в организме.
- •2.Меланины
- •58. Биосинтез креатина, креатинфосфата и креатинина в организме. Карнитин, карнозин, ансерин. Их роль в организме
- •59. Синтез и катаболизм гема. Значение конъюгирования продуктов метаболизма гема в печени.
- •75.Классификация и функции липидов.
- •76.Окисление жирных кислот.Реакции пути в-окисления.
- •77.Синтез и использование кетоновых тел.Изменения метаболизма при голодании.
- •78.Образование триацилглицеринов из углеводов.Метаболизм триацилглицеринов. Переваривание пищевых жиров. Депонирование и мобилизация жиров.
- •79.Стероиды.Роль и биосинтез холестерина в организме.
- •80.Механизмы формирования атеросклеротического повреждения сосудов.
- •82. Классификация, метаболизм, функции лп. Дислипопротеинемии.
- •83. Биологические активные вещества. Витамины.
- •67.Строение функции углеводов(ув)
- •69. Глюкоза как важнейший метаболит углеводного обмена. Источники и пути использования глюкозы в организме.
- •Вопрос 73. Соотношение превращений субстратов и процессов, происходящих в печени, мышцах и жировой ткани.
- •Регуляция гликолиза и глюконеогенеза.
- •Вопрос 74. Биосинтез и мобилизация гликогена. Схема регуляции активности гликогенфосфорилазы и гликогенсинтазы.
- •Гликгенолиз.
- •Ингибирование субстратом
- •90. Регуляторные полипептиды. Калликреин-кининовая и ренин-ангиотензиновая системы организма.
- •92.Интеграция и регуляция метаболизма. Направление потоков ключевых метаболитов между различными метаболическими путями.
- •84.Механизмы передачи гормонального сигнала.
- •Гидрофильные:
- •Липофильные
- •Вопрос 86.Синтез и секреция кортикостер.Г.Их роль
- •Вопрос87.Синтез и секреция гормонов щитов.Железы
- •Вопрос 88.Синтез и секреция половых гормонов.
- •Вопрос 89.Простагландины и их роль.
- •48.Лекарства и другие ингибиторы трансляции.
- •94.Интеграция метаболизма основных специализированных тканей организма человека.
- •50. Молекулярные механизмы канцерогенеза. Пути активации протоонкогенов.
- •49.Регуляция экспрессии генов.
- •13. Последовательность и методы изучения первичной и вторичной структуры белка
- •20.Классификация и номенклатура ферментов.
- •21. Механизмы ферментативного катализа. Энергия активации. Образование фермент-субстратного комплекса.
- •22.Типы ферментативных реакций.Механизмы 2-х субстратных реакций.Механизм ферментативного действия пиридоксаль-зависимого фермента аланинаминотрансферазы.
- •54 Катаболизм углеродного скелета ак. Кетогенные и гликогенные аминокислоты.
- •55 Биогенные амины:гистамины, серотонин, катехоламины. Происхождение и функции в организме.
- •56 Обмен фенилаланина и тирозина. Болезни, вызванные генетическими дефектами ферментов обмена этих аминокислот.
- •93 Интеграция и регуляция метаболизма. Стратегии регуляции потока метаболитов.
Вопрос 24. Зависимость скорости ферментативной реакции от рН, температуры, концентрации фермента, субстрата.
 Линейная
зависимость
Линейная
зависимость
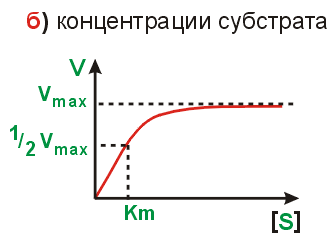
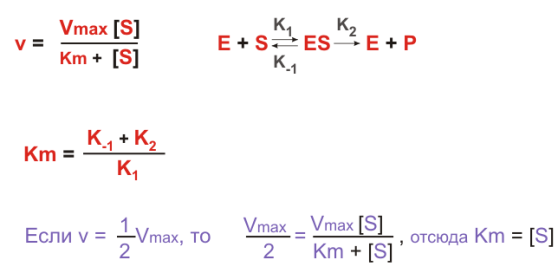
Vmax – активные центры всех молекул
Увеличение [S] накапливающегося в рез-те реакции ↓ V реакции
При небольших конц. [S] – реакции 1-го порядка.(v не зависит от конц [S])
Математическое описание зависимости V и S. Бриттс Холдейн
Для односубстратных реакций в условиях стационарной кинетики
Накапл. [S]
Конц. Продуктов ph мала (нет ингибиторов)
v→s ФСК=v его распада
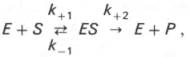
Кm представляет собой константу Михаэлиса, являющуюся экспериментально определяемой величиной. Она может быть представлена следующим уравнением:

k-1 – скорость распада
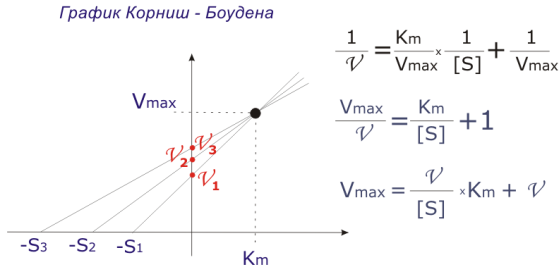
по константе михаэлиса судят о степени сродства субстрата и фермента. Чем ниже Km значит тем быстрее идёт ферм.р-ция. Графический способ опр. Графический способ определения Km.





 ph-оптимум-
значение ph
при котором реакция протекает наиболее
быстро. Для большинства E
он лежит в пределах от 6 до 8
ph-оптимум-
значение ph
при котором реакция протекает наиболее
быстро. Для большинства E
он лежит в пределах от 6 до 8

28.Регуляция активности ферментов. Ключевые ферменты-ферменты, запускающие метаболический путь, а также ферменты, лимитирующие скорость его протекания. Лимитирующая реакция – реакция с самой высокой энергией активации. Факторы регуляции скорости протекания метаболического пути:1)общие условия регулируют активность Ф. – концентрация Ф. и субстрата (S), значение рН,t0,времени;2)Аллостерическая регуляция - специальные, специфические активаторы и ингибиторы являются эффекторами (фактор активации – работа АЦ и S;фактор ингибирования – несоответствие АЦ и S). Эффектор может взаимодействовать непосредственно с каталитической субъединицей, и с регуляторной субъединицей, которая дает команду к формированию каталитической субъединице. Объединение субъединиц в олигомерный комплекс усиливает чувствительность Ф в ответ на малое колебание концентрации эффекторов. Олигомерность приводит к явлению кооперативности. Присоединение облегчает последующее взаимодействие субъед. и S. Олигомерность ускоряет или тормозит активность Ф в ответ на незначительные колебания концентрации S. 3)Активация предшественников (форактивация): 1 метаболит активирует Ф, катализирующий последующую стадию (необязательно ближайшую).4)ретроингибирование – торможение по принципу обратной связи, адекватная быстрая регуляция прямого метаболического пути.5)хим.модификация белков – Ф: к белку-Ф ковалентно присоединятся хим.функц.группа, что активирует или ингибирует деятельность Ф. Ф находится в активном состоянии несколько минут, а затем модифицированная группа удаляется с помощью лиаз.6)Хроническая регуляция – подавление синтеза ненужного в данный момент Ф, активация синтеза нужного; контроль на уровне генома: транскрипция/трансляция.7)регуляция активности Ф через гормоны: гормон-первичный сигнализатор→ рецептор→ регуляция активности.8) компартментализация: в клетке Ф и S могут быть разделены мембраной. Любой фактор, оказывающий влияние на проницаемость мембраны, будет являться регулятором активности ФК. Удаление продукта реакции (пространственное разообщение) также влияет на скорость. В случае разделения мембраной продукта и Ф, реакция протекает под ингибирование др. влияний.9)активация Ф путем протеолиза – для формирования АЦ
29. Изоферменты и целесообразность определения изоферментного спектра в медицине. Изоферм – разные молекуляр формы одного и того же ферм, кодирующиеся родственными генами. Отличаются рядом структурных, катализирующих и метаболич св-в: разные ферм имеют разные рН-оптимум, отличаются степенью сродства к субстрату и кофакторам, чувствит к активаторам и ингибиторам, скоростью синтеза и распада. Благодаря набору изоферм клетка обладает способностью к тонкой адаптации. Тканевые изоферм отвечают за приспосабливание ткани и оптимальное протекание р-ии при имеющихся условиях. 1) Изоферм могут быть гибридами двух видов полипепт цепей: креатинкиназа, ЛДГ, изоферм имеющие более 2-х полипепт цепочек. 2) аллелозины – генетич вариант одного и того же ферм, встречается у организмов – глюкозо-6-фосфат-ДГ. 3) генетич независимые изоферм, кодируются разными генами, может быть разная внутриклеточная организация (малатДГ,аминотрансфераза).

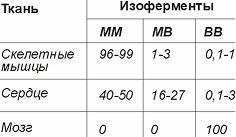
30.
Мультиферментные системы. Локализация
Ф:
мультиФ системы – надмолекулярный
комплекс из нескольких Ф, которые
работают сообща. Продукт 1 Ф→S
для 2![]() продукты
2 Ф
S
для 3. 1
тип:
Ф свободно расположены в цитоплазме –
все Ф гликолиза, Ф фосфоглюконатного
пути. 2
тип:
Ф объединены в комплекс с
определ.пространственной организацией.
S,
попав в комплекс, не покидает его пока
не образуется конечный продукт:
синтетазный комплекс жирных кислот,
пируватдегидрогеназный комплекс.3
тип:
отдельные Ф мультиФ комплекса присоединены
к опр.клеточным структурам: отд. Ф
дых.цепи связаны с внутр. Мембраной МХ,
а др. Ф – нет; отдельные Ф синтеза белка
– в рибосомах, а др. – где-то рядом.
Локализация Ф: внутри
клетки
- в составе цитоплазмы в опр.органеллах,
встроены в мембрану. Могут быть отдельные
отсеки, различающиеся по метаболитическим
процессам. Все Ф гликолиза – в цитоплазме,
Ф ЦТК, β-окисления жирных кислот – в
матриксе МХ. Органоспецифические Ф –
в одном или нескольких органах.
продукты
2 Ф
S
для 3. 1
тип:
Ф свободно расположены в цитоплазме –
все Ф гликолиза, Ф фосфоглюконатного
пути. 2
тип:
Ф объединены в комплекс с
определ.пространственной организацией.
S,
попав в комплекс, не покидает его пока
не образуется конечный продукт:
синтетазный комплекс жирных кислот,
пируватдегидрогеназный комплекс.3
тип:
отдельные Ф мультиФ комплекса присоединены
к опр.клеточным структурам: отд. Ф
дых.цепи связаны с внутр. Мембраной МХ,
а др. Ф – нет; отдельные Ф синтеза белка
– в рибосомах, а др. – где-то рядом.
Локализация Ф: внутри
клетки
- в составе цитоплазмы в опр.органеллах,
встроены в мембрану. Могут быть отдельные
отсеки, различающиеся по метаболитическим
процессам. Все Ф гликолиза – в цитоплазме,
Ф ЦТК, β-окисления жирных кислот – в
матриксе МХ. Органоспецифические Ф –
в одном или нескольких органах.
