
- •Маса атома. Відносна атомна маса
- •Молярна маса речовини
- •2.Основні закони хімії
- •Еквівалент. Визначення еквіваленту хімічного елементу, оксиду, кислоти, основи чи солі. Закон еквівалентів
- •Ядерна модель будови атомів. Закон Мозлі. Атомні ядра, їх склад. Ізотопні та ізобарні ядра.
- •Розподіл електронів по орбітах. Принцип Паулі. Правило Гунда-Клечковського
- •Головне та побічне квантові числа. Енергетичні рівні. Магнітне та спінове квантові числа.
- •Електронні конфігураці, електронні формули. Електронні родини елементів.
- •Периодичний закон та структура периодичної системи елементів Менделєєва. Енергія іонізації, спорідненність до електрона, електронегативність елемента.
- •Метод валентних зв’язків. Полярний та неполярний ковалентний зв'язок. Металічний зв'язок.
- •Властивості ковалентного зв’язку. - та - зв’язки
- •Іонний зв'язок. Водневий зв'язок, його біологічна роль.
- •Ступень окиснення. Процеси окиснення та відновлення. Метод електронного балансу.
- •12/1 Метод перманганотометричного титрування.
- •Поняття про розчини. Способи вираження концентрації розчинів: масова частка, молярна, нормальна та молярна концентрації. Титр розчину.
- •Внутрішня енергія системи. Нульовий закон термодинаміки. Перший закон термодинаміки.
- •Ентальпія системи. Теплові ефекти. Екзо- та ендотермічні процеси.
- •Закон Гесса. Наслідок із закону Гесса.
- •Поняття про ентропію. Рівняння Больцмана. Енергія Гіббса.
- •Іонний добуток води. Поняття про водневий та гідроксильний показники. Поняття про індикатори.
- •Швидкість хімічної реакції та фактори, що на неї впливають. Правило Вант-Гоффа.
- •Вплив концентрації реагуючих речовин на швидкість реакції. Закон діючих мас.
- •22.Оборотні та необоротні процеси. Стан хімічної рівноваги. Константа хімічної рівноваги.
- •23. Принцип Ла Шательє. Вплив температури, тиску та концентрації реагуючих речовин на зміщення хімічної рівноваги. Пояснити на прикладах.
- •24. Основні положення координіційної теорії Вернера. Класифікація координаційних сполук.
- •25. Номенклатура координаційних сполук. Пояснити на прикладах.
- •26. Природа хімічного звязку в координаційних сполуках. Метод валентних звязків.
- •27. Дисоціація комплексних сполук. Поняття про константу нестійкості.
- •28. Застосування комплексонатів мікроєлементів у тваринництві.
- •29. Способи добування, фізичні та хімічні властивості водню. Пероксид водню, його біологічна роль. Скласти відповідні реакції.
- •30. Хімія сполук карбону. Оксиди карбону, карбонатна кислота: добування та властивості. Біологічна роль карбону.
Хімія. Теоретичні питання
Маса атома. Відносна атомна маса
Значення мас атомів, що виражаються в стандартних одиницях маси (абсолютна атомна маса ma, дуже малі, тому використовувати їх у повсякденній практиці дуже незручно. Наприклад, маса атому Карбону дорівнює:
![]()
|
Відносною атомною масою елемента називають відношення абсолютної маси атому до 1/12 частину абсолютної маси атому Карбону, ядро якого містить шість протонів і шість нейтронів. Позначають відносну атомну масу елемента символом Ar,
Абсолютна та відносна маси пов’язані простим співвідношенням:
![]()
У таблиці Д. І. Менделєєва відносна атомна маса хімічного елемента вказується звичайно в нижній частині клітини з символом хімічного елемента. Значення Ar округлюється відповідно до правил математики. Винятком є атомна маса Хлору, яка становить 35,5.
Число нейтронів у ядрі атома дорівнює різниці між округленим до цілого числа значенням відносної атомної маси та числом протонів.
Відносна молекулярна маса — це фізична величина, що дорівнює відношенню маси речовини певного формульного складу до 1/12 маси атома Карбону. Як зрозуміти вираз «формульний склад»? Це склад речовини, що визначається її формулою. Якщо є потреба визначити відносну молекулярну масу речовини, то зовсім не обов'язково ділити масу речовини певного формульного складу на 1/12 маси атома Карбону, як випливає із визначення. Достатньо просто додати відносні атомні маси елементів, які входять до формульного складу речовини, пам'ятаючи при цьому, що відносна молекулярна чи формульна маса — безрозмірна величина. Наприклад: Мr(N2) - 2Аr(N); Мr(N2) = 2 • 14 = 28;
Молярна маса речовини
Кількість речовини один моль, тобто порція, яка обов’язково містить 6,02·1023 частинок, має масу, характерну саме для цієї речовини. Наприклад, один моль заліза Fe відповідає масі 56 г, один моль води H2O - масі 18 г. Таку характеристику речовини — масу одного моль даної речовини — називають молярною масою та позначають M. Молярна маса речовини чисельно дорівнює відносній атомній масі, якщо речовина складається з атомів, або відносній молекулярній масі, якщо речовина складається з молекул. Це чисельне співпадіння пояснюється тим, що в одному грамі міститься 6,02·1023 атомних одиниць маси, в яких виражаються відносні атомні та молекулярні маси.
Оскільки молярна маса показує масу одного моля, вона має розмірність г/моль. Таким чином, розрахувати молярну масу можна аналогічно до розрахунку відносної молекулярної маси речовини, що визначається як сума відносних атомних мас елементів, що входять до складу речовини, з урахуванням їхньої кількості. Але треба пам’ятати, що відносна атомна та відносна молекулярна маси є безрозмірними величинами, а молярна маса виражається в г/моль.
Наприклад, визначимо молярну масу води H2O:
|
M
(H2O)
= 2 · Ar(H)
+ Ar(O)
= 2 · 1 + 16 = 18
![]()
Молярна
маса речовини
— це відношення маси даної порції
речовини до кількості речовини в цій
порції:
![]() .За
допомогою цієї формули можна визначити
кількість речовини, якщо відома маса
речовини, та навпаки.
.За
допомогою цієї формули можна визначити
кількість речовини, якщо відома маса
речовини, та навпаки.
Наприклад, визначимо масу 3 моль вуглекислого газу CO2. Спочатку визначаємо молярну масу CO2:
M (CO2) = Ar(C) + 2 · Ar(O) = 12 + 2 · 16 = 44
Масу речовини визначаємо за формулою: m = ν · M.
Маса вуглекислого газу дорівнює:
m(CO2) = 3 моль · 44 = 132 г.
Тепер визначимо кількість речовини амоніаку NH3 масою 3,4 г. Визначаємо молярну масу NH3:
M (NH3) = Ar(N) + 3 · Ar(H) = 14 + 3 · 1 = 17
Кількість
речовини визначаємо за формулою:
![]() .
.
Кількість речовини амоніаку дорівнює:
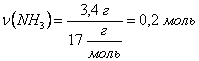 .
.
