
- •I.Основные понятия и законы химии:
- •2.Основные классы органических соединений.
- •3 Строение атома.
- •4.Переодический закон.
- •5. Химическая связь
- •5) Гибридизация атомных орбиталей:
- •6. Понятие об окислительно-восстановительных процессах.
- •3) Уравнения окислительно-восстановительных реакций на примере взаимодействия простых веществ с кислородом:
- •4) Влияние характера среды на протекание овр на примере перманганата калия
- •5)Окислительно-восстановительная двойственность на примере перекиси водорода, сульфита натрия:
- •7. Общие законы протекания химических реакций.
- •Виды энергии
- •Закон Гесса
- •7.Общие законы протекания хим.Реакиций.
- •8. Понятие о химической кинетике.
I.Основные понятия и законы химии:
Химия – наука, изучающая состав, строение, свойства веществ, а также превращения этих веществ и законы, которым подчиняются эти превращения.Предмет химии — химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции. Химия[1] имеет много общего с физикой и биологией, по сути граница между ними условна. Современная химия является одной из самых обширных дисциплин среди всех естественных наук. Основные этапы развития:1. Предалхимический период: до III в. н.э.2. Алхимический период: III – XVI вв.Алхимия - это самозабвенная попытка найти способ получения благородных металлов. В реализации алхимического рецепта предполагалось участие священных или мистических сил, а средством обращения к этим силам было слово - необходимая сторона ритуала. 3. Период становления (объединения) химии: XVII – XVIII вв.происходит её полная рационализация. Химия освобождается от натурфилософских и алхимических взглядов на элементы как на носители определённых качеств. начинает вырабатываться единый взгляд на химические процессы и в полной мере использоваться экспериментальный метод. 4. Период количественных законов (атомно-молекулярной теории): 1789 – 1860 гг.ознаменовавшийся открытием главных количественных закономерностей химии – стехиометрических законов, и формированием атомно-молекулярной теории, окончательно завершает превращение химии в точную науку, основанную не только на наблюдении, но и на измерении.5. Период классической химии: 1860 г. – конец XIX в. 6. Современная химия: XX – начало XXI вв.
Физические и химические изменения вещества. Переход физического тела из одного состояния в другое представляет собой физическое изменение или физическое явление. К физическим явлениям относятся: переход тела из жидкого в парообразное (газообразное) или твердое состояние и наоборот, увеличение объема тела при его нагревании или уменьшение объема при охлаждении, переход тепла от одного тела к другому, механическое движение тел и другие явления, при которых вещество тела не меняется.Изменение вещества, в результате которого оно приобретает другие химические свойства или образуются новые вещества, называется химическим явлением. Превращение одних веществ в другие, отличающиеся от исходных составом и свойствами, происходит при химических реакциях. В процессе химических реакций атомы переходят из одних молекул в другие и образуются молекулы новых химических веществ.
Химический анализ: Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы. Количественный анализ — совокупность методов аналитической химии для определения количества (содержания) элементов (ионов), радикалов, функциональных групп, соединений или фаз в анализируемом объекте.
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Менделеева.Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные).
Химический синтез — в узком смысле это процесс создания или построения сложных молекул из более простых. В широком смысле — получение химических соединений химическими и физическими методами. В зависимости от природы продукта синтез может быть органическим или неорганическим. Следует отметить, что в органическом синтезе, продуктом химической реакции может являться и более простым веществом, чем одно из исходных соединений..
Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат). Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
Химическое обозначение. Химический знак или символ обозначает название элемента, это буквы латинских названий элементов. Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элемента (например, H — водород от лат. Hydrogenium)
Хими́ческая фо́рмула — условное обозначение химического состава и структуры веществ с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура вещест.Химическая формула может обозначать или отражать:1 молекулу или 1 моль вещества;качественный состав (из каких химических элементов состоит вещество);количественный состав (сколько атомов каждого элемента содержит реальная или условная молекула вещества). Примеры: Формула HNO3 обозначает:азотную кислоту; 1 молекулу азотной кислоты или 1 моль азотной кислоты; качественный состав: молекула азотной кислоты состоит из водорода, азота и кислорода;количественный состав: в состав молекулы азотной кислоты входят один атом элемента водорода, один атом элемента азота, три атома элемента кислорода.
Моле́кула— электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества. Совмещение понятий «молекула» и «атом» идёт вразрез с атомно-молекулярным учением, по которому молекула образуется из атомов. Из одного атома молекула образоваться не может. Обычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены); заряженные молекулы называют ионами. молекулы с неспаренными электронами и ненасыщенными валентностями — радикалами.
А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Валентность Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки. Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь(Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома).
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.мАбсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м.Относительная атомная масса — одна из основных характеристик химического элемента. Относительной молекулярной массой М, вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12С. Вместо термина «относит атомная масса» можно использовать термин «атомная масса». Относ молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества.
Относительная молекулярная масса (Mr)- безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Вещество В соответствии с классическими научными воззрениями различаются две физические формы существования материи — вещество и поле.Вещество — это форма материи, обладающая массой покоя (масса покоя не равна нулю). Химия изучает большей частью вещества, организованные в атомы, молекулы, ионы и радикалы. Те, в свою очередь, состоят из элементарных частиц: электронов, протонов,нейтронов и т. д.
Смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонент).В смеси исходные вещества включены неизменными. При этом нередко исходные вещества становятся неузнаваемыми, потому что смесь обнаруживает другие физические свойства по сравнению с каждым изолированным исходным веществом. При смешивании не возникает, тем не менее, никакое новое вещество. Специфические качества смеси, например, плотность, температура кипения или цвет, зависят от соотношения компонентов смеси (массовое отношение).
Классификация веществ
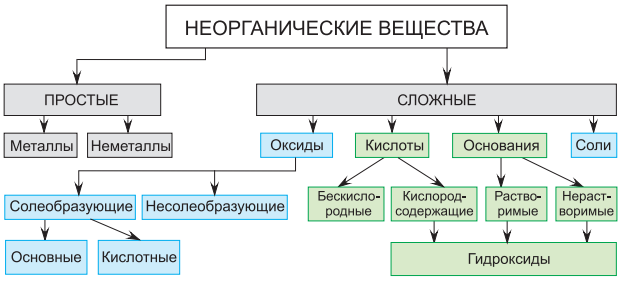
Простые вещества — это вещества, образованные из атомов одного элемента.Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот—атомами элемента азота.Сложные вещества, -- это вещества, образованные атомами разных элементов.Так, оксид меди (II) образован атомами элементов меди и кислорода, вода — атомами элементов водорода и кислорода. Сложные неорганические вещества принято подразделять на четыре класса: оксиды, основания (гидроксиды), кислоты, соли.
Моль — единица измерения количествавещества . Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.Значение NA = 6,022…×1023 называется числом Авогадро Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация —диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Классификация:
Реакция обмена(Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями) Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:Реакция соединения(При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава) Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:СаСО3 + СО2 + Н2О = Са(НСО3)2, так и относиться к числу окислительно-восстановительных:2FеСl2 + Сl2 = 2FеСl3.Реакция разложения(Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества) Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества. Cu(OH)2=CuO + H2O. Реакции замещенияПри реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное. Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:2Аl + Fe2O3 = 2Fе + Аl2О3.
Стехиометрия -, в химии учение о количественных соотношениях между массами (объёмами) реагирующих веществ (простых и сложных). С. включает вывод химических формул, составление уравнений химических реакций, расчёты, применяемые в химическом анализе.
ЗАКОН СОХРАНЕНИЯ МАССЫ. Новые вещества не получаются из ничего и не могут обратиться в ничто. Масса (вес) реагентов всегда в точности равна массе (весу) продуктов химической реакции. Этот фундаментальный закон впервые открыл русский ученый М.В.Ломоносов. Немного позже французский химик А.Лавуазье пришел к тем же выводам и независимо от Ломоносова сформулировал тот же закон. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех жехимических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии.
Закон кратных отношений — Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа. Закон кратных отношений открыт в 1803 Дж.Дальтоном.
Закон объемных отношений гласит Объемы вступающих в реакцию газов относятся друг к другу и у объемам образующихся газообразных продуктов реакции как небольшие целые числа.Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуются 2 объема водяного пара. Конечно, при этом предполагается, что все измерения объемов проведены при одном и том же давлении и при одной и той же температуре.
Закон Авога́дро —«в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано в 1811 году Амедео Авогадро .Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были объяснены в 1811 году итальянским физиком Амедео Авогадро. Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём. В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.Число́ Авога́дро, конста́нта Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. NA = 6,022 141 29(27)·1023 моль−1.
