
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •1Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны.
- •Вопрос90 Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91 Соединение углерода с галогенами и серой. Четыреххлористый углерод, фосген, фреоны, сероуглерод и тиокарбонаты. Цианаты и тиоцианаты. Физ. И хим. Свойства, применение .
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
Вопрос90 Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна sp гибридиз.(2 сигмы и 2 пи связи).
СО2 О====С===О 0,116нм

Диоксид углерода С02 (углекислый газ). Молекула С02 линейна sp гибридиз.(2 сигмы и 2 пи связи
Получение В промышленности
Ca2CO3 (t )= CaO + CO
В лаборатори :
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
СО2 - слабо растворим в в
CO2 + H2O =H2CO3
CO2 + NaOH = NaHCO3
CO2 + CaO = CaCO3
Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции.
![]()
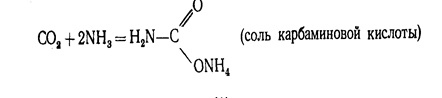
При нагревании этой соли получают ценное удобрение - карбамид СО (МН2) 2:
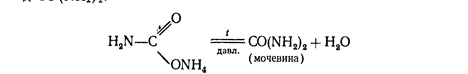
Мочевина разлагается водой
CO (NH2) 2+2Н2O= (МН4) 2СОз.
Из галогенидов углерода самое большое значение имеет-бесцветная, достаточно токсичная жидкость. В обычных условиях ССІ4химически инертен. Его применяют как невоспламеняющийся и негорючий растворитель смол, лаков, жиров, а также для получения фреона CF2CІ2 (Ткип= 303 К):
![]()
Другой используемый в практике органический растворитель - сероуглерод CSa(бесцветная, летучая жидкость с Ткип=319 К) – реакционно способное вещество:
CS2+302=C02+2S02+258 ккал/моль,
CS2+3Cl2=CCl4-S2Cl2,CS2+2H2 0==C02+2H2S, CS2+K2S=K2CS3 (соль тиоугольной кислоты Н2СSз). Пары сероуглерода ядовиты



Вопрос 91 Соединение углерода с галогенами и серой. Четыреххлористый углерод, фосген, фреоны, сероуглерод и тиокарбонаты. Цианаты и тиоцианаты. Физ. И хим. Свойства, применение .
Сероуглерод получают пропусканием паров серы сквозь слой раскаленного угля. Это бесцветная жидкость с температурой кипения 460. Широко используется в органической химии качестве растворителя. . Молекула CS2 линейна, длина связи С—S = 0,15529 нм;
Сероуглерод токсичен, огнеопасен, имеет самый широкий диапазон концентрационных пределов взрываемости
Подобно диоксиду углерода, CS2 является кислотным ангидридом и при взаимодействии с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3)... Такими сильными окислителями, как, например, перманганат калия, сероуглерод разлагается с выделением серы.
![]()
С оксидом хлора(I) образует фосген:
![]()
образуются соли дитиокарбаматы:
![]()
Для растворимых дитиокарбаматов характерно образование комплексов с металлами, что используется в аналитической химии. Они также имеют большое промышленное значение в качестве катализаторов вулканизации каучука.
Со спиртовыми растворами щелочей образует ксантогенаты:
![]()
Серуглерод хлорируется в присутствии катализаторов до перхлорметилмеркаптана CCl3SCl, использующегося в синтезе тиофосгенаCSCl2:
![]()
![]()
Избытком хлора сероуглерод хлорируется до четыреххлористого углерода:
![]()
При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:
![]()
В
промышленности получают по реакции
![]()
Также сероуглерод можно получить взаимодействием древесного угля и паров S при 750—1000 °C.
.Его применяют для получения различных химических веществ (ксантогенатов, четыреххлористого углерода, роданидов).
Сероуглерод очень ядовит. Смертельная доза при поступлении внутрь составляет 1 г.
соединения углерода с галогенами. обычно рассматривают как производные углеводородов, в которых водород полностью замещен на галоген.
Дихлороксоуглерод (фосген СОCl2 - хлорангидрид угольной кислоты. Это
бесцветный газ (t кип. =8,2 С Газ с удушливым неприятным запахом, который сравнивают с запахом гнилых плодов, прелого сена и т, п. Т. плавл. -118°, т. кип. 8,2°, плотн, паров 3,5; плотн, жидкого 1,42 0°/4°); давл. паров 1169,0 мм рт. ст. (19,7°); коэфф. раств, в воде ~2Хорошо растворяется в ледяной уксусной кислоте, бензоле. плохо растворим в воде и
медленно реагирует с ней с образованием двух кислот:
COCl2 + H2 O =H2CO3+ 2HCl
COCl + 4NH3 > CO(NH2)2 + 2NH4Cl.
Фосген важный промежуточный продукт в промышленной химии,
применяется как сырь в производстве красителей, мочевины,
изоционатов, безводных хлоридов металлов ,пестицидов, лекарств
и растворителей. Фосген является отравляющим веществом
удушающего действия.
*Жидкий Ф. - хороший растворитель для некоторых химических веществ. Ф. сорбируется и нейтрализуется активным углем, пемзой, а также натриевой известью и уротропином.
при соприкосновении с влагой воздуха дымит вследствие образования НС1.. *Под влиянием света н при нагревании (около 200°) диссоциирует на Сl2 и СО. С аммиаком образует мочевину. Общий характер действия. Вызывает отек легких в результате поражения капилляров легких, ведущего к резкому повышению проницаемости для воды и белка капилляров и стенок легочных альвеол.
Четыреххлористый углерод (тетрахлометан, CHCl4) - бесцветная жидкость. Раств. воды в ССl4 около 1% (24°). Не воспламеняется. При соприкосновении с пламенем или накаленными предметами разлагается, образуя фосген. Может содержать в виде примесей СS2, НСl, Н2S, органические сульфиды. Применяется как растворитель; для экстрагирования жиров и алкалоидов; при производстве фреонов; в огнетушителях; для чистки и обезжиривания одежды в быту и производственных условиях. Получается хлорированием СS2 в присутствии катализаторов; каталитическим хлорированием СН4 (вместе с СН2С12 и СНСl3); накаливанием смеси угля и СаСl2 при температуре вольтовой дуги.
Фреоны (хладоны) — техническое название группы насыщенных алифатических фторсодержащих углеводородов, применяемых в качестве хладагентов, , растворителей. Фрео́ны — галогеноалканы, фтор- и хлорсодержащие производные насыщенных углеводородов (главным образом метана и этана), используемые как хладагенты вхолодильных машинах (например, в кондиционерах). Кроме атомов фтора, в молекулах фреонов содержатся обычно атомы хлора, реже — брома. Известно более 40 различных фреонов; большинство из них выпускается промышленностью.
Фреоны — бесцветные газы или жидкости, без запаха. Хорошо растворимы в неполярных органических растворителях, очень плохо — в воде и полярных растворителях.
Фреоны очень инертны в химическом отношении, поэтому они не горят на воздухе, невзрывоопасны даже при контакте с открытым пламенем. Однако при нагревании фреонов свыше 250 °C образуются весьма ядовитые продукты, например фосген COCl2, который в годы первой мировой войны использовался как боевое отравляющее вещество.
Устойчивы к действию кислот и щелочей.
Применяется в парфюмерии и медицине для создания аэрозолей.
Применяется в пожаротушении
CS2-дисульфид углерода(сероуглерод) представляет собой легко воспламеняющуюся жидкость Ткип. 46,2
CS2 -является сульфидом, обладающим кислотными свойствами и при
взаимодействии с основными сульфидами образует тиоугольной кислоты
тиокарбонаты:
Na2 S + CS2 > Na2 CS3
Действием кислот на тиокарбонаты выделяется свободная тиоугольная кислота H2 CS 3:
Na 2CS3 + 2HCl >2NaCl + H2CS3 .
Слабая тиоугольная кислота более стабильна, чем угольная, но в водном растворе Постепенно разлагается: H2CS3 + 3Н2О > H2СО3 + 3Н 2S
При температуре выше 150 С сероуглерод реагирует с водой:
CS2 + 2H2O --- СО2 + 2H2S.
Цианаты — производные циановой кислоты, общая структурная формула которой: —NCO, ЦИАНАТЫ, содержатгруппу NCO. Цианаты бывают простые — соли циановой кислотыHNCOи комплексные. Молекулы цианатов относятся к нежестким молекулам.Координацияцианат-иона с ионом металла осуществляется преим. через атом азота. Т.обр., Цианаты существуют в осн. в изоформе — в виде изоцианатов. Цианаты наз. также псевдогалогенидами (Неустойчивость водного р-ра HNCO и склонность цианат-ионов к образованию малорастворимыхдвойных цианатов является препятствием в синтезе простых цианатов мн. металлов. Цианаты щелочных и щел.-зем. металлов, в отличиеот цианатов тяжелых металлов, раств. в воде. Цианат аммония при нагр. разлагаетсяс образованием мочевины, цианат натрия слабо разлагается при 600 °С в присут.Fe или Ni, давая цианид и карбонат Na, CO и N2. Цианат калия при700-900 °С разлагается до KCN, в присут. СuО энергично окисляется при нагревании.Цианаты щелочных металлов и аммония гидролизуются во влажном воздухе и водныхр-рах с образованием карбонатов, аммиака и СО2. Цианаты калия и натрияс минер. к-тами дают HNCO, с мочевиной — биурет NH2CONHCONH2,к-рый, в свою очередь, реагируя с цианатами, дает цианураты и аммиак.

металлов известны гомолигандные анионные комплексы лишь для Ga, In, Sn и Pb, к-рые получают совместнойкристаллизацией цианата металла и цианата тетраметиламмония или К в полярных орг.р-рителях, напр. [(CH3)4N]3[Ga(NCO)6].Образующиеся кристаллич. продукты хорошо раств. в полярных р-рителях. Аналогичнополучают гетеролигандные координац. соед. при совместной кристаллизацииKNCS и соответствующих цианатов металлов в полярных р-рителях, напр. K3[Ga(NCO)3(NCS)3]x ТГФ. Полученные комплексы хорошо раств. в ДМСО, ДМФА, этаноле (кромекомплексов Рb), плохо — в ацетоне, диэтиловом эфире. Цианаты гл. обр. используют в орг. синтезе. Из цианатов аммония и щелочных металлов получают разл. производные мочевой к-тыи мочевины. Цианаты значительно менее токсичны, чем цианиды,что используют для дезактивации последних окислением (Н2О2,КМnО4) до цианатов с послед. гидролизом. Тиоцианаты (тиоцианиды, роданиды, сульфоцианиды) — соли роданистоводородной (тиоциановой) кислоты. Содержат ион SCN−. Физико-химические свойства Неорганические тиоцианаты являются кристаллическими веществами с высокими температурами плавления. Тиоцианаты щелочных металлов и аммония имеют формулу Me+NCS-, для других тиоцианатов возможна формула Me(SCN)x. Неорганические тиоцианаты вступают в реакции окисления, восстановления, галогенирования и обмена:
![]()
![]()
![]()
![]()
![]()
Кроме того, тиоцианаты могут образовывать комплексные соединения. В них лиганд - тиоцианат-ион - может координироваться как атомом азота, так и атомом серы, например, тетрароданоферрат калия: K[Fe(SCN)4]. Реакция образования окрашенного в кроваво-красный цвет тетрароданоферрата калия служит в аналитической химии качественной реакцией на ион Fe3+.
При термической изомеризации тиоцианата аммония образуется тиомочевина:
![]()
Получение и применение
Тиоцианаты получают реакцией элементарной серы или полисульфидов с цианидами. Эти реакции позволяют перевести токсичный цианид-ион в гораздо менее опасный тиоцианат-ион:
![]()
![]()
В промышленности тиоцианаты щелочных металлов получают взаимодействием растворов соответствующих полисульфидов с коксовым газом, содержащим примеси цианидов; тиоцианат аммония — по реакции аммиака с сероуглеродом.
В аналитической химии применяются как реактив на ионы трёхвалентного железа, с которым образуют кроваво-красные тиоцианатные комплексы Fe(III), а также для фотометрического определения некоторых металлов (например, кобальта, железа, висмута, молибдена, вольфрама, рения).
Тиоцианаты применяются в производстве тиомочевины, являются реагентами в процессах крашения и печатании тканей, в аналитической химии (качественный и количественный анализ), как ядохимикаты (инсектициды и фунгициды), стабилизаторы горения взрывчатых веществ, в процессах выделения и разделения редких металлов, для получения органических тиоцианатов. Тиоцианаты ниобия(V) и тантала(V) служат в качестве катализаторов реакции Фриделя-Крафтса.
