
- •Вопрос 86 Общая характеристика группы.
- •Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
- •1Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны.
- •Вопрос90 Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
- •Вопрос 91 Соединение углерода с галогенами и серой. Четыреххлористый углерод, фосген, фреоны, сероуглерод и тиокарбонаты. Цианаты и тиоцианаты. Физ. И хим. Свойства, применение .
- •Вопрос 92 Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации
Вопрос 88 Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
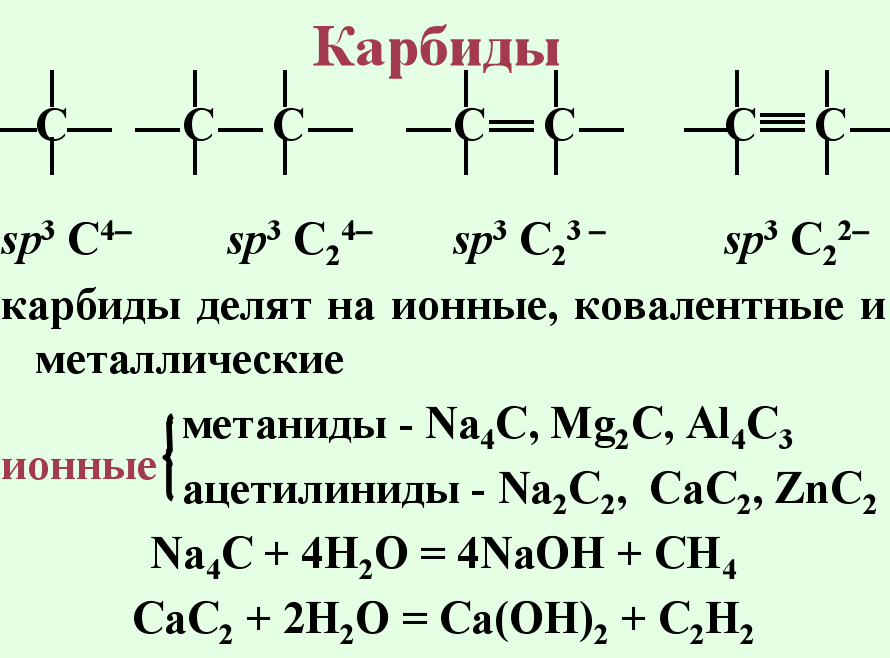
Карбиды. Углерод образует с металлами, бором и кремнием разнообразные соединения, называемые карбидами. Наиболее активные металлы (IA-IIIA подгрупп) образуют солеподобные карбиды, например Na2C2, CaC2, Mg4C3, Al4C3. В промышленности карбид кальция получают из кокса и известняка по следующим реакциям:
Карбиды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения где углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т.п.)
Карбиды — тугоплавкие твёрдые вещества, не растворимы] ни в одном из известных растворителей. . Карбиды-бинарные соединения углерода с более электроположительными элементам . Карбиды (по хим. Связи) смотри схему
1Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны.
Металлоподобные карбиды имеют промежуточную химическую активность.
Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар. В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов.
Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O = 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С),
а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС=С–СН3.
Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O = 3Mn(OH)2 + CH4 + H2.
Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4.
2Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. часто отличаются большой твердостью и очень высокими температурами плавления.
Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно). Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали), а также для производства очень твердых сплавов Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет. Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов,
Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). 3К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного
Бор
образует по два карбида с точно известной
структурой – В4С и В13С2.



Вопрос 89 Оксид углерода(II), его КО и ОВ характеристика, свойства как лиганда, химические основы его токсичности. Цианистоводородная кислота, простые и комплексные цианиды. Химичиские основы токсичности цианидов.



Уникальной является способность оксида углерода (II) при повышенных температурах и давлениях образовывать с некоторыми металлами необычные (комплексные) соединения, называемые карбонилами: Ni+4CO=Ni(CO)4 -связях.-связях, наоборот, от металла к лиганду. В результате атом металла переходит в состояние близкое к нейтральному. Именно так ведет себя молекула СО, выполняющая роль акцептора в -связях заряд переносится от лиганда к металлу, а в -электронов позволяет понять особенность электронной структуры карбонильных комплексов. Если металл, соединяясь с лигандом, обнаруживает невысокие значения валентности, то в - и При обычных условиях жидкостями являются карбонилы Ni(CO)4, Fe(CO)5, Ru(CO)5, Os(CO)5. Все остальные представляют собой кристаллические вещества. Карбонилы металлов диамагнитны, что указывает на наличие спаренных электронов. Все они отличаются высокой устойчивостью по отношению к различным химическим реагентам. Относительная независимость в трактовке поведения При нагревании карбонилы металлов разлагаются на СО и металл, что используетсядляполучения металлов высокой чистоты.

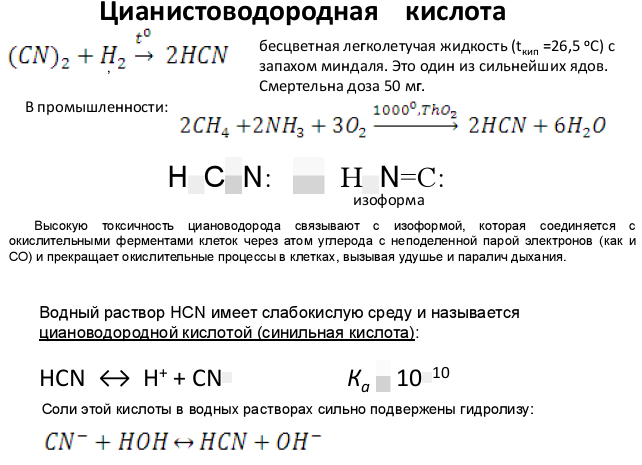

Токсичность цианидов определяется недиссоциированной цианистой кислотой и цианид-ионами. Цианиды — это ферментативные яды, блокирующие железосодержащий фермент — цитохромоксидазу, что приводит к нарушению тканевого дыхания и асфиксии.
Наиболее токсичны для рыб простые соединения — цианистая кислота, цианиды натрия и калия. Цианиды и аммиак, цианиды и р-крезол являются синергистами. При недостатке кислорода чувствительность к цианидам резко повышается.
Комплексные цианистые соединения меди, цинка, никеля и железа сравнительно малотоксичны.
