
СЕРДЦЕ
Циркуляцию крови по сердечно-сосудистой системе (рис. 23–1, 23–14) обеспечивает насосная функция сердца — непрерывная работа миокарда (сердечной мышцы), характеризующаяся чередованием систолы (сокращения) и диастолы (расслабления).
Сердце (рис. 23–1) состоит из четырёх камер — двух предсердий и двух желудочков. Для обозначения левых отделов сердца (предсердия и желудочка) иногда применяют термин «левое сердце», правых отделов сердца — «правое сердце». Желудочки во время диастолы заполняются кровью, а во время систолы — выбрасывают её в аорту и лёгочной ствол, реализуя основную функцию сердца — насосную. Систоле желудочков предшествует систола предсердий. Таким образом, предсердия служат вспомогательными насосами, способствующими заполнению желудочков.
· Из левых отделов сердца кровь нагнетается в аорту, через артерии и артериолы поступает в капилляры, где и происходит обмен между кровью и тканями. Через венулы кровь направляется в систему вен и далее в правое предсердие. Это большой круг кровообращения — системная циркуляция.
· Из правого предсердия кровь поступает в правый желудочек, который перекачивает кровь через сосуды лёгких. Это малый круг кровообращения — лёгочная циркуляция.
Сердце сокращается в течение жизни человека до 4 млрд раз, выбрасывая в аорту и способствуя поступлению в органы и ткани до 200 млн л крови. В физиологических условиях сердечный выброс составляет от 3 до 30 л/мин. При этом кровоток в различных органах (в зависимости от напряжённости их функционирования) варьирует, увеличиваясь при необходимости приблизительно вдвое.
Для клинической практики особенно важно то обстоятельство, что при нарушениях насосной функции левого или правого отдела сердца возникает застой крови в венозном отделе малого или большого круга кровообращения: при недостаточности насосной функции левых отделов сердца — в малом круге кровообращения (откуда левые отделы перекачивают кровь в большой круг кровообращения, т.е. кровь застаивается лёгких), правых отделов сердца — соответственно в большом круге (кровь застаивается в системах нижней и верхней полых вен).
ОБОЛОЧКИ СЕРДЦА
Стенка всех четырёх камер имеет три оболочки: эндокард, миокард и эпикард.
· Эндокард выстилает изнутри предсердия, желудочки и лепестки клапанов — митрального, трёхстворчатого, клапана аорты и клапана лёгочного ствола.
· Миокард состоит из рабочих (сократительных), проводящих и секреторных кардиомиоцитов.
à Рабочие кардиомиоциты содержат сократительный аппарат и депо кальция (цистерны и трубочки саркоплазматического ретикулума). Эти клетки при помощи межклеточных контактов (вставочные диски) объединены в так называемые сердечные мышечные волокна — функциональный синцитий (совокупность кардиомиоцитов в пределах каждой камеры сердца).
à Проводящие кардиомиоциты образуют проводящую систему сердца, в том числе так называемые водители ритма.
Ú Водители ритма (пейсмейкерные клетки). Их главное свойство — способность в диастолу сердца самостоятельно генерировать электрический импульс (т.е. возбуждаться), распространяющийся затем по проводящей системе и вызывающий сокращение миокарда. Процесс генерации импульса в водителях ритма обозначают термином спонтаннаядиастолическая деполяризация плазматической мембраны. При достижении критического значения трансмембранного потенциала возникает потенциал действия (ПД), распространяющийся по длинным волокнам проводящей системы и достигающий рабочих кардиомиоцитов (ПД в рабочих кардиомиоцитах приводит к их сокращению).
Ú Главный водитель ритма. Водители ритма в разных отделах проводящей системы сердца характеризуются неодинаковой скоростью спонтанной диастолической деполяризации. Быстрее всего она происходит в клетках синусно-предсердного (синусного) узла — он генерирует ПД с частотой 60–90 в минуту (что обеспечивает сокращение сердца именно с такой частотой). Это главный водитель ритма (водитель ритма первого порядка). При его активности, что характерно для нормально функционирующего сердца, активность других (нижележащих) водителей ритма подавлена.
Ú Иерархия водителей ритма. Если водитель ритма первого порядка по каким-либо причинам не генерирует ПД с указанной частотой, функция водителя ритма переходит к нижележащим отделам проводящей системы сердца, в которых спонтанная диастолическая деполяризация происходит медленнее, что отражается в меньшей частоте сердечных сокращений (ЧСС). В целом иерархия водителей ритма характеризуется следующей закономерностью: чем ближе к рабочим миоцитам, тем реже спонтанный ритм.
Ú Сердечные блокады. При нарушениях проведения электрического импульса (возбуждения) по проводящей системе сердца из-за её патологических изменений возникают так называемые сердечные блокады и другие нарушения ритма.
à Секреторные кардиомиоциты. Часть кардиомиоцитов предсердий (особенно правого) синтезирует и секретирует вазодилататор атриопептин — гормон, регулирующий АД.
· Функции миокарда: возбудимость, автоматизм, проводимость и сократимость.
à Автоматизм — способность самостоятельно генерировать ПД для сокращения миокарда всего сердца; денервированное сердце продолжает сокращаться, так как автоматизмом обладают даже рабочие кардиомиоциты, однако скорость спонтанной диастолической деполяризации у них минимальна.
à Сократимость — способность сокращаться, реализуя тем самым насосную функцию сердца.
à Проводимость — способность проводить ПД; проводимостью обладает каждый кардиомиоцит.
à Возбудимость — способность возбуждаться (генерировать ПД) в ответ на воздействие раздражителя.
Под влиянием различных воздействий (нервной системы, гормонов, различных ЛС) функции миокарда изменяются: влияние на ЧСС (т.е. на автоматизм) обозначают термином «хронотропное действие» (может быть положительным и отрицательным), на силу сокращений (т.е. на сократимость) — «инотропное действие» (положительное или отрицательное), на скорость предсердно-желудочкового проведения (что отражает функцию проводимости) — «дромотропное действие» (положительное или отрицательное), на возбудимость — «батмотропное действие» (также положительное или отрицательное).
· Эпикард формирует наружную поверхность сердца и переходит (практически слит с ним) в париетальный перикард — париетальный листок околосердечной сумки, содержащей 5–20 мл перикардиальной жидкости.
Сердечная тампонада. При избыточном скоплении жидкости в околосердечной сумке (например, при травмах грудной клетки) возникает сердечная тампонада — сдавление сердца, существенно нарушающее его насосную функцию, поскольку в диастолу объём камер сердца не увеличивается и кровь не поступает в должном количестве в желудочки и, соответственно, в большой и малый круги кровообращения.
Между миокардом и внутренней поверхностью эпикарда находится соединительная ткань, содержащая жировые клетки. Все крупные артерии расположены именно в этой части эпикарда, откуда их ветвления проникают в миокард.
КЛАПАНЫ СЕРДЦА
Эффективная насосная функция сердца зависит от однонаправленного движения крови из вен в предсердия и далее в желудочки, создаваемого четырьмя клапанами (на входе и выходе обоих желудочков, рис. 23–1). Все клапаны (предсердно-желудочковые и полулунные) закрываются и открываются пассивно.
· Предсердно–желудочковые клапаны — трёхстворчатый клапан в правом желудочке и двустворчатый (митральный) клапан в левом — препятствуют обратному поступлению крови из желудочков в предсердия. Клапаны закрываются при градиенте давления, направленном в сторону предсердий, — т.е. когда давление в желудочках превышает давление в предсердиях. Когда же давление в предсердиях становится выше давления в желудочках, клапаны открываются.
От свободных краёв предсердно-желудочковых (АВ-) клапанов отходят сухожильные хорды (chordae tendineae), представляющие собой соединительнотканные тяжи. Прикрепляются сухожильные хорды к сосочковыми мышцами миокарда желудочков. При сокращении миокарда сокращаются и сосочковые мышцы, что не позволяет створкам клапанов выпячиваться в сторону предсердий в систолу желудочков. Вполне естественно, что при местном нарушении кровообращения миокарда вследствие недостаточного обеспечения кислородом и питательными веществами (обычно при инфаркте или приступе стенокардии) нарушается его сократительная способность. Ишемия миокарда сосочковых мышц приводит к выпячиванию створок в предсердия — створки клапанов расходятся и кровь затекает обратно в предсердия, что клинически проявляется систолическим шумом недостаточности митрального или (гораздо реже) трикуспидального клапана во время приступа стенокардии или при инфаркте миокарда.
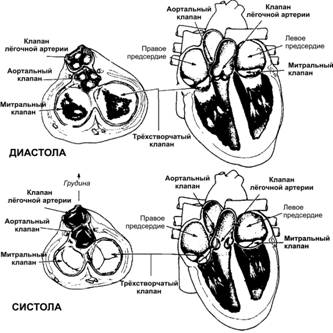
Рис. 23–1. Клапаны сердца. Слева — поперечные (в горизонтальной плоскости) срезы через сердце, зеркально развёрнутые относительно схем справа. Справа — фронтальные срезы через сердце. Вверху — диастола,внизу — систола.
· Полулунные клапаны — аортальный клапан и клапан лёгочной артерии — расположены на выходе из левого и правого желудочков соответственно. Они предотвращают возврат крови из артериальной системы в полости желудочков. Оба клапана представлены тремя плотными, но очень гибкими «кармашками», имеющими полулунную форму и прикреплёнными симметрично вокруг клапанного кольца. «Кармашки» открыты в просвет аорты или лёгочного ствола, поэтому когда давление в этих крупных сосудах начинает превышать давление в желудочках (т.е. когда последние начинают расслабляться в конце систолы), «кармашки» расправляются кровью, заполняющей их под давлением, и плотно смыкаются по своим свободным краям — клапан захлопывется (закрывается).
à Механизм действия аортальных клапанов и клапанов лёгочной артерии отличается от функционирования АВ-клапанов следующими особенностями.
Ú Высокое давление в артериях в конце систолы заставляет полулунные клапаны резко захлопываться, в отличие от более постепенного («лёгкого») смыкания АВ-клапанов.
Ú Через узкое отверстие полулунных клапанов скорость изгоняемой крови намного выше, чем через большие предсердно-желудочковые отверстия.
Ú Высокая скорость закрытия и быстрый выброс крови подвергают края полулунных клапанов большему механическому воздействию, чем края АВ-клапанов.
Ú Наконец, АВ-клапаны поддерживаются сухожильными хордами, отсутствующие у полулунных клапанах.
à В основание створок аортального клапана (практически в полость «кармашков») открываются устья венечных артерий. Кровь в эти артерии поступает во время диастолы, когда давление в аорте превышает давление в левом желудочке и створки полулунных клапанов расправлены и сомкнуты. Соответственно, когда створки этих клапанов не смыкаются (например, вследствие деформации их свободных краёв, что служит одной из причин недостаточности аортального клапана), страдает коронарный кровоток, что в итоге вносит свой вклад в возникновение выраженной стенокардии напряжении, очень типичной для аортальной недостаточности.
ТОНЫ СЕРДЦА
Выслушивание (аускультация) стетофонендоскопом левой половины грудной клетки позволяет услышать два тона сердца: I тон и II тон сердца. I тон связан с закрытием АВ-клапанов в начале систолы, II — с закрытием полулунных клапанов аорты и лёгочной артерии в конце систолы. Причина возникновения тонов сердца — вибрация напряжённых клапанов тотчас после закрытия совместно с вибрацией прилежащих сосудов, стенки сердца и крупных сосудов в области сердца.
· I тон образуется при сильном и быстром сокращении желудочков, в процессе которого давление в полости желудочков резко увеличивается, что приводит к закрытию и дальнейшему прогибанию клапанов в сторону предсердий до тех пор, пока сухожильные хорды клапанов внезапно не остановят это прогибание. Эластическая упругость сухожильных хорд и клапанов создаёт обратную ударную волну крови, направленную соответственно в каждый желудочек. Это приводит кровь, стенку желудочков, упругие клапаны в состояние вибрации и порождает вибрирующую турбулентность крови. Вибрация через прилежащие ткани достигает стенки грудной клетки и воспринимается в виде звука, слышимого с помощью стетофонендоскопа.
· II тон — результат быстрого закрытия полулунных клапанов. В момент закрытия они прогибаются в направлении полости желудочков. Их эластическая отдача толкает кровь в артерии, вызывая короткий период реверберации крови между стенкой артерий и полулунными клапанами. Вибрация стенки артерий передаётся вдоль артерий. Вибрация сосудов или желудочка, достигающая стенки грудной клетки, воспринимается в виде звука.
Продолжительность I тона составляет 0,14 с, II — 0,11 с. II тон сердца имеет более высокую частоту, чем I. Звучание I и II тонов сердца наиболее близко передаёт сочетание звуков при произнесении словосочетания «ЛАБ-ДАБ». Помимо I и II тонов, иногда можно выслушать дополнительные тоны сердца — III и IV, в подавляющем большинстве случаев отражающие наличие сердечной патологии.
· III тон возникает в начале диастолы (сразу после II тона) в результате колебаний стенки желудочка, вызванных пассивным поступлением крови из предсердия. Как вариант нормы, III тон можно выслушать у детей, взрослых до 35–40 лет, а также в третьем триместре беременности. Появление III тона у лиц старше 40 лет — всегда патологический признак.
· IV тон связан с быстрым наполнением желудочков за счёт сокращений предсердий (желудочки оказывают повышенное сопротивление заполняющей их крови). Этот тон выслушивают непосредственно перед I тоном в конце диастолы желудочков. Его наличие всегда свидетельствует о патологии сердца.
III и IV тоны сердца имеют низкое и довольно глухое звучание, поэтому выслушивают их стетоскопом (лучше передающим низкие частоты).
ИССЛЕДОВАНИЯ, ПОЗВОЛЯЮЩИЕ ОЦЕНИТЬ КЛАПАННЫЙ АППАРАТ СЕРДЦА
Фонокардиография — регистрация звуковых колебаний с поверхности грудной клетки, записываемых на большой скорости с помощью специального микрофона. Клинически этот метод применяют для записи тонов и шумов сердца при поражениях клапанного аппарата. В настоящее время метод используют довольно редко, поскольку доказано, что аускультативная характеристика далеко не всегда соответствует степени поражения клапанов, оцениваемого с помощью эхокардиоскопии: выраженные клапанные пороки могут быть афоничными, а хорошо слышный шум может сопровождать безобидные нарушения (например аномальные сухожильные хорды, натянутые не от створки клапана к сосочковой мышце, а просто между противоположными стенками желудочка — эффект струны).
Эхокардиоскопия (менее корректный термин — «эхокардиография»), лучше в сочетании с допплерографией, — неинвазивный метод получения изображения, основанный на отражении ультразвуковых волн от стенок и клапанов сердца и изменении волновых характеристик звука, отражённых от движущихся объектов (в данном случае — эритроцитов крови). Метод используют для исследования движения стенок сердца и оценки тока крови в камерах сердца, что позволяет выявить всевозможные пороки сердца — как врождённые, так и приобретённые.
НАРУШЕНИЯ КЛАПАННОГО АППАРАТА
ШУМЫ
В основе любого шума в сердце и сосудистом русле лежит возникновение турбулентного тока крови. Наиболее часто шумы в сердце обусловлены патологией аортального и митрального клапанов.
· Шум при стенозе аортального клапана. При стенозе аорты кровь изгоняется из левого желудочка через суженное отверстие между створками аортального клапана. Кровь с большой скоростью проходит через узкое отверстие, турбулентный поток ударяет в стенки аорты и вызывает громкий шум во время систолы (т.е. систолический шум). Шум передаётся на сосуды шеи. Шум чаще имеет грубый «скребущий» характер. Одна из наиболее обычных причин аортального стеноза — атеросклеротическое поражение створок аортального клапана.
· Шум недостаточности аортального клапана (аортальной регургитации) появляется во время диастолы, когда вследствие неплотного смыкания клапанов кровь устремляется обратно в левый желудочек, что формирует турбулентный ток, слышимый ухом.
Стеноз аортального клапана и аортальная недостаточность приводят к развитию гипертрофии левого желудочка с увеличением его массы в 4–5 раз. Для преодоления сопротивления стеноза аорты внутрижелудочковое давление может повышаться до 400 мм рт.ст. Тем не менее в обеих ситуациях страдает насосная функция сердца, что приводит к развитию систолической сердечной недостаточности.
· Шум при недостаточности митрального клапана (митральной регургитации). Вследствие неплотного смыкания створок митрального клапана кровь во время систолы поступает обратно в левое предсердие, создавая высокочастотный шум, напоминающий шум, возникающий при аортальной недостаточности, но наиболее хорошо выслушиваемый именно в проекции митрального клапана.
· Шум при митральном стенозе возникает вследствие сужения левого предсердно-желудочкового отверстия, вследствие чего кровь с трудом проходит из левого предсердия в левый желудочек во время диастолы. Шум обычно имеет невысокую интенсивность, поэтому выслушать его сложнее.
Митральная регургитация и митральный стеноз уменьшают эффективность насосной функции левых отделов сердца — создаются благоприятные условия для застоя крови в малом круге кровообращения и, как следствие, — для развития отека лёгких. Кроме того, вследствие растяжения левого предсердия (иногда с увеличением размеров его полости в 2 раза) такие больные склонны к возникновению фибрилляции предсердий (хаотичному сокращению небольших участков миокарда предсердий, поэтому единая скоординированная систола предсердий отсутствует).
ВРОЖДЁННЫЕ ДЕФЕКТЫ СЕРДЦА
Врождённые дефекты сердца проявляются в виде патологии клапанов (1), патологии крупных сосудов — их стенозов, аномалий отхождения от сердца и др. (2), аномальных отверстий и сообщений между камерами сердца и/или сосудами (3).
· Дефект межпредсердной перегородки — наличие постоянного отверстия (дефекта) в межпредсердной перегородке, сообщающего левое и правое предсердие.
· Дефект межжелудочковой перегородки (ДМЖП) — наличие постоянного отверстия в межжелудочковой перегородке, что приводит к сбросу крови по градиенту давления из левого желудочка в правый, т.е. к смешиванию высокооксигенированной и низкооксигенированной крови. ДМЖП — наиболее часто наблюдаемый врождённый порок сердца.
· Открытый артериальный проток — врождённый порок сердца, характеризующийся незаращением сосуда между лёгочной артерией и аортой (боталлова проток) в течение 8 нед после рождения (во внутриутробном периоде функционирование протока необходимо для сброса крови из лёгочной артерии, несущей кровь в пока ещё не дышащие лёгкие, в аорту; см. рис. 20–7).
· Тетрада Фалло — самый распространённый цианотический (синий) врождённый порок сердца, частота которого составляет 10% всех пороков. Характерны четыре компонента: 1) большой высокорасположенный ДМЖП (подобное расположение дефекта приводит к тому, что левый и правый желудочки практически имеют одно выходное отверстие); 2) стеноз лёгочной артерии; 3) декстропозиция аорты (расположение её в том числе и над выходом из правого желудочка — аорта «сидит верхом» над ДМЖП), 4) компенсаторная гипертрофия правого желудочка.
· Стеноз аорты — группа врождённых пороков, субстратом которых выступает сужение выходного тракта левого желудочка: 1) под аортальным клапаном (например, при локальном утолщении межжелудочковой перегородки); 2) стеноз собственно аортального клапана; 3) стеноз самой аорты над клапаном (вследствие наличия неполных мембран, перекрывающих просвет аорты).
· Коарктация аорты — сегментарное сужение («перетяжка») просвета аорты, обычно обнаруживаемое при переходе её дуги в нисходящую часть.
· Стеноз лёгочной артерии. При этом пороке имеется сращение створок клапана лёгочной артерии в области их комиссур. При этом клапан имеет куполообразную форму и узкое отверстие в центральной части.
КРОВОСНАБЖЕНИЕ СЕРДЦА
Стенку сердца снабжают кровью правая и левая венечные (коронарные) артерии. Обе венечные артерии отходят от основания аорты (вблизи места прикрепления створок аортального клапана). Задняя стенка левого желудочка, некоторые отделы перегородки и большая часть правого желудочка кровоснабжаются правой венечной артерией. Остальные отделы сердца получают кровь из левой венечной артерии (рис. 23–2).

Рис. 23–2. Венечные артерии сердца [10]. А — по передней стенке сердца: 1 — аорта, 2 — лёгочные вены, 3 — левая венечная артерия, 4 — огибающая ветвь левой венечной артерии, 5 — передняя межжелудочковая ветвь левой венечной артерии, 6 — правая венечная артерия; Б — по задней стенке сердца: 1 — аорта, 2 — лёгочные вены, 3 — правая венечная артерия, 4 — задняя межжелудочковая ветвь правой венечной артерии, 5 — огибающая ветвь левой венечной артерии.
· При сокращении левого желудочка миокард пережимает венечные артерии, и поступление крови к миокарду практически прекращается — 75% крови по венечным артериям притекает к миокарду во время расслабления сердца (диастолы) и низкого сопротивления сосудистой стенки. Для адекватного коронарного кровотока диастолическое давление крови не должно опускаться ниже 60 мм рт.ст.
· При физической нагрузке коронарный кровоток усиливается, что связано с увеличением работы сердца по снабжению мышц кислородом и питательными веществами. Венечные вены, собирая кровь от большей части миокарда, впадают в венечный синус в правом предсердии. От некоторых областей, расположенных преимущественно в «правом сердце», кровь поступает непосредственно в сердечные камеры.
· Ишемическая болезнь сердца (ИБС) развивается вследствие локального сужения просвета крупной или среднего калибра венечной артерии из-за наличия атеросклеротической бляшки. В этом случае коронарный кровоток усиливаться не может, что необходимо в первую очередь при физической нагрузке, поэтому при ИБС физическая активность приводит к возникновению болей в сердце.
КРОВОСНАБЖЕНИЕ ПЛОДА
Обогащённая кислородом кровь (см. рис. 20–7) с относительно низкой концентрацией СО2 из плаценты по пупочной вене поступает в печень, а из печени — в нижнюю полую вену. Часть крови из пупочной вены через венозный проток, минуя печень, сразу попадает в систему нижней полой вены. В нижней полой вене происходит перемешивание крови. Кровь с высоким содержанием СО2 поступает в правое предсердие из верхней полой вены, которая собирает кровь из верхней части тела. Через овальное отверстие (отверстие в межпредсердной перегородке) часть крови поступает из правого предсердия в левое. При сокращении предсердий клапан закрывает овальное отверстие, и кровь из левого предсердия поступает в левый желудочек и далее в аорту, т.е. в большой круг кровообращения. Из правого желудочка кровь направляется в лёгочную артерию, которая артериальным (боталловым) протоком связана с аортой. Следовательно, через артериальный проток и овальное отверстие сообщаются малый и большой круги кровообращения.
На ранних этапах внутриутробной жизни потребность в крови в несформированных лёгких, куда перекачивает кровь правый желудочек, ещё не велика. Поэтому степень развития правого желудочка определяется уровнем развития лёгких. По мере развития лёгких и увеличения их объёма всё больше крови направляется к ним и всё меньше проходит через артериальный проток. Закрытие артериального протока происходит вскоре после рождения (в норме — до 8 нед жизни), когда лёгкие начинают получать всю кровь из правых отделов сердца. После рождения перестают функционировать и редуцируются, превращаясь в соединительнотканные тяжи, и другие сосуды (сосуды пуповины и венозный проток). Овальное отверстие закрывается также после рождения.
ИННЕРВАЦИЯ СЕРДЦА
Работу сердца контролируют сердечные центры продолговатого мозга и моста через парасимпатические и симпатические волокна (рис. 23–3). Холинергические и адренергические (преимущественно безмиелиновые) волокна образуют в стенке сердца несколько нервных сплетений, содержащих внутрисердечные ганглии. Скопления ганглиев в основном сосредоточены в стенке правого предсердия и в области устьев полых вен.
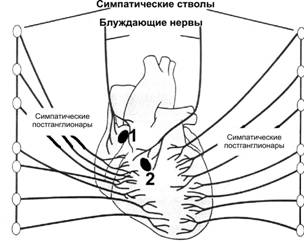
Рис. 23–3. Иннервация сердца. 1 — синусно-предсердный узел, 2 — предсердно-желудочковый узел (АВ-узел).
· Парасимпатическая иннервация. Преганглионарные парасимпатические волокна для сердца проходят в составе блуждающего нерва с обеих сторон. Волокна правого блуждающего нерва иннервируют правое предсердие и образуют густое сплетение в области синусно-предсердного узла. Волокна левого блуждающего нерва подходят преимущественно к АВ-узлу. Именно поэтому правый блуждающий нерв оказывает влияние главным образом на ЧСС, а левый — на АВ-проведение. Желудочки имеют менее выраженную парасимпатическую иннервацию.
à Внутрисердечные нейроны почти все холинергические (парасимпатические). На них, а также на МИФ‑клетках (малых интенсивно флюоресцирующих клетках — разновидности нейронов, находящихся практически во всех вегетативных ганглиях), заканчиваются терминали холинергических аксонов блуждающего нерва.
à Эффекты парасимпатической иннервации: сила сокращений предсердий уменьшается — отрицательный инотропный эффект, ЧСС снижается — отрицательный хронотропный эффект, предсердно-желудочковая задержка проведения увеличивается — отрицательный дромотропный эффект.
· Симпатическая иннервация. Преганглионарные симпатические волокна для сердца идут от боковых рогов верхних грудных сегментов спинного мозга. Постганглионарные адренергические волокна образованы аксонами нейронов ганглиев симпатической нервной цепочки (звёздчатый и отчасти верхний шейный симпатические узлы). Они подходят к органу в составе нескольких сердечных нервов и равномерно распределяются по всем отделам сердца. Терминальные ветви пронизывают миокард, сопровождают венечные сосуды и подходят к элементам проводящей системы. Миокард предсердий имеет более высокую плотность адренергических волокон. Каждый пятый кардиомиоцит желудочков снабжается адренергической терминалью, заканчивающейся на расстоянии 50 мкм от плазмолеммы кардиомиоцита.
à Эффекты симпатической иннервации: сила сокращений предсердий и желудочков увеличивается — положительный инотропный эффект, ЧСС возрастает — положительный хронотропный эффект, интервал между сокращениями предсердий и желудочков (т.е. задержка проведения в АВ-соединении) укорачивается — положительный дромотропный эффект.
В целом стимуляция симпатических нервов увеличивает скорость спонтанной деполяризации мембран водителей ритма (т.е. ЧСС), облегчает проведение ПД в волокнах Пуркинье и увеличивает частоту и силу сокращения рабочих кардиомиоцитов; стимуляция парасимпатических нервов, наоборот, уменьшает частоту генерации импульсов пейсмейкерами, снижает скорость проведения ПД в волокнах Пуркинье и уменьшает силу сокращения и ЧСС.
Между симпатической и парасимпатической иннервацией существуют реципрокные тормозные отношения. Ацетилхолин действует пресинаптически, уменьшая выделение норадреналина из симпатических нервов. Нейропептид Y, выделяющийся из норадренергических окончаний, тормозит выделение ацетилхолина.
· Афферентная иннервация. Чувствительные нейроны ганглиев блуждающих нервов и спинномозговых узлов (C8–Th6) образуют свободные и инкапсулированные нервные окончания в стенке сердца. Афферентные волокна проходят в составе блуждающих и симпатических нервов.
Свойства миокарда
Основные свойства сердечной мышцы — возбудимость, автоматизм, проводимость, сократимость.
ВОЗБУДИМОСТЬ
Возбудимость — свойство отвечать на раздражение электрическим возбуждением в виде изменений мембранного потенциала (МП) с последующей генерацией ПД. Электрогенез в виде МП и ПД определяется разностью концентраций ионов по обе стороны мембраны, а также активностью ионных каналов и ионных насосов. Через пору ионных каналы ионы проходят по электрохимическому градиенту, тогда как ионные насосы обеспечивают движение ионов против электрохимического градиента. В кардиомиоцитах наиболее распространённые каналы — для ионов Na+, K+, Ca2+ и Cl–.
Типы ионных каналов кардиомиоцитов суммированы в табл. 23–1.
Таблица 23–1. Ионные каналы кардиомиоцитов
Потенциалозависимые каналы |
Na+‑каналы |
Ca2+в — временно открывающиеся каналы, открытые только при значительной деполяризации |
Ca2+д — каналы, длительно открытые во время деполяризации |
K+-входящие выпрямляющие |
K+-выходящие выпрямляющие |
K+-выходящие временно открытые |
Лиганд-воротные K+‑каналы |
Ca2+-активированные |
Na+-активированные |
АТФ-чувствительные |
Ацетилхолин-активированные |
Арахидоновой кислотой активированные |
· МП покоя кардиомиоцита составляет –90 мВ. Стимуляция порождает распространяющийся ПД, вызывающий сокращение (рис. 23–4). Деполяризация развивается быстро, как в скелетной мышце и нерве, но, в отличие от последних, МП возвращается к исходному уровню не сразу, а постепенно.
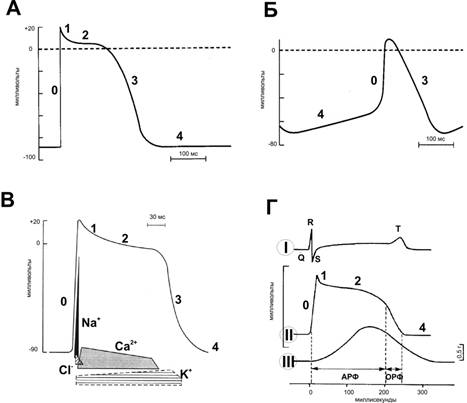
Рис. 23–4. Потенциалы действия. А — Желудочек. Б — Синусно-предсердный узел. В — Ионная проводимость. I — ПД, регистрируемый с поверхностных электродов; II — внутриклеточная регистрация ПД; III — Механический ответ. Г — Сокращение миокарда. АРФ — абсолютная рефрактерная фаза; ОРФ — относительная рефрактерная фаза. 0 — деполяризация; 1 — начальная быстрая реполяризация; 2 — фаза плато; 3 — конечная быстрая реполяризация; 4 — исходный уровень.
· Деполяризация длится около 2 мс, фаза плато и реполяризация продолжаются 200 мс и более. Как и в других возбудимых тканях, изменение внеклеточного содержания K+ влияет на МП; изменения внеклеточной концентрации Na+ воздействуют на величину ПД.
Ú Быстрая начальная деполяризация (фаза 0) возникает вследствие открытия потенциалозависимых быстрых Na+‑каналов, ионы Na+ быстро устремляются внутрь клетки и меняют заряд внутренней поверхности мембраны с отрицательного на положительный.
Ú Начальная быстрая реполяризация (фаза 1) — результат закрытия Na+‑каналов, входа в клетку ионов Cl– и выхода из неё ионов K+.
Ú Последующая продолжительная фаза плато (фаза 2 — МП некоторое время сохраняется приблизительно на одном уровне) — результат медленного открытия потенциалозависимых Ca2+‑каналов: ионы Ca2+ поступают внутрь клетки, равно как ионы и Na+, при этом ток ионов K+ из клетки сохраняется.
Ú Конечная быстрая реполяризация (фаза 3) возникает в результате закрытия Ca2+‑каналов на фоне продолжающегося выхода K+ из клетки через K+‑каналы.
Ú В фазу покоя (фаза 4) происходит восстановление МП за счёт обмена ионов Na+ на ионы K+ посредством функционирования специализированной трансмембранной системы — Na+-К+‑насоса. Указанные процессы касаются именно рабочего кардиомиоцита; в клетках водителя ритма фаза 4 несколько отличается.
· Быстрый Na+‑канал имеет наружные и внутренние ворота. Наружные ворота открываются в начале деполяризации, когда МП равен –70 или –80 мВ; при достижении критического значения МП внутренние ворота закрываются и предотвращают дальнейший вход ионов Na+ до тех пор, пока ПД не прекратится (инактивация Na+‑канала). Медленный Ca2+‑канал активируется небольшой деполяризацией (МП в пределах от –30 до –40 мВ).
· Сокращение начинается сразу после начала деполяризации и продолжается в течение всего ПД. Роль Ca2+ в сопряжении возбуждения с сокращением подобна его роли в скелетной мышце (см. главу 6). Однако в миокарде триггером, активирующим T-систему и вызывающим выделение Ca2+ из саркоплазматической сети, выступает не сама деполяризация, а внеклеточный Ca2+, поступающий внутрь клетки во время ПД.
· На протяжении фаз 0–2 и примерно до середины фазы 3 (до достижения МП во время реполяризации уровня –50 мВ) мышца сердца не может быть возбуждена снова. Она находится в состоянии абсолютного рефрактерного периода, т.е. состоянии полной невозбудимости.
· После абсолютного рефрактерного периода возникает состояние относительной рефрактерности, в котором миокард остаётся до фазы 4, т.е. до возвращения МП к исходному уровню. В период относительной рефрактерности сердечная мышца может быть возбуждена, но только в ответ на очень сильный стимул.
· Сердечная мышца не может, как скелетная мышца, находиться в тетаническом сокращении. Тетанизация (стимуляция высокой частотой) сердечной мышцы в течение сколько-нибудь продолжительного времени приведёт к летальному исходу. Мускулатура желудочков должна быть рефрактерной; говоря иными словами, быть в «периоде неуязвимости» до конца ПД, поскольку стимуляция миокарда в этот период может вызывать фибрилляцию желудочков, которая при достаточной длительности фатальна для больного.
АВТОМАТИЗМ И ПРОВОДИМОСТЬ
Автоматизм — способность пейсмейкерных клеток инициировать возбуждение спонтанно, без участия нейрогуморального контроля. Возбуждение, приводящее к сокращению сердца, возникает в специализированной проводящей системе сердца и распространяется посредством неё ко всем частям миокарда.
ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА. Структуры, входящие в состав проводящей системы сердца, — синусно-предсердный узел, межузловые предсердные пути, АВ-соединение (нижняя часть проводящей системы предсердий, прилегающая к АВ-узлу, собственно АВ-узел, верхняя часть пучка Хиса), пучок Хиса и его ветви, система волокон Пуркинье (рис. 23–5).
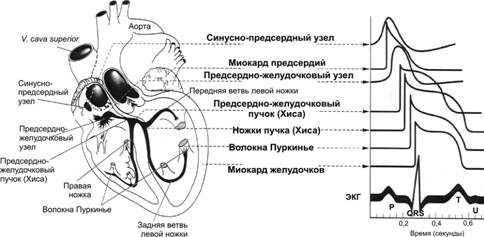
Рис. 23–5. Слева — проводящая система сердца. Справа — типичные ПД [синусового (синусно-предсердного) и АВ-узлов (предсердно-желудочкового), других частей проводящей системы и миокарда предсердий и желудочков] в корреляции с ЭКГ.
ВОДИТЕЛИ РИТМА. Все отделы проводящей системы способны генерировать ПД с определённой частотой, определяющей в конечном итоге ЧСС, — т.е. быть водителем ритма. Однако синусно-предсердный узел генерирует ПД быстрее других отделов проводящей системы, и деполяризация от него распространяется в другие участки проводящей системы прежде, чем они начнут спонтанно возбуждаться. Таким образом, синусно-предсердный узел — ведущий водитель ритма, или водитель ритма первого порядка. Частота его спонтанных разрядов определяет частоту биений сердца (в среднем 60–90 в минуту).
ФУНКЦИОНАЛЬНАЯ АНАТОМИЯ ПРОВОДЯЩЕЙ СИСТЕМЫ СЕРДЦА
· Топография. Синусно-предсердный узел располагается в месте впадения верхней полой вены в правое предсердие. Предсердно–желудочковый узел (АВ-узел) находится в правой задней части межпредсердной перегородки, непосредственно позади трёхстворчатого клапана. Связь между синусно-предсердным и АВ-узлами осуществляется двумя путями: диффузно миоцитами предсердия и по специальным внутрисердечным проводящим пучкам. АВ-узел служит только проводящим путём между предсердиями и желудочками. Он продолжается в пучок Хиса, подразделяющийся на левую и правую ножки и мелкие пучки. Левая ножка пучка Хиса, в свою очередь, делится на переднюю и заднюю ветви. Ножки и пучки проходят под эндокардом, где контактируют с системой волокон Пуркинье; последние распространяются ко всем частям миокарда желудочков.
· Асимметрия вегетативной иннервации. Синусно-предсердный узел происходит из эмбриональных структур правой стороны тела, а АВ-узел — из структур левой стороны тела. Это объясняет факт, почему правый блуждающий нерв преимущественно распределён в синусно-предсердном узле, а левый блуждающий нерв — в АВ-узле. Соответственно, симпатическая иннервация правой стороны распределена преимущественно в синусно-предсердном узле, симпатическая иннервация левой стороны — в АВ-узле.
· Потенциалы действия. В правой части рис. 23–5 представлены типичные трансмембранные потенциалы для синусно-предсердного и АВ-узлов, а также других отделов проводящей системы: ствола Хиса, ножек пучка Хиса, волокон Пуркинье, предсердной и желудочковой мышц и их корреляция с электрической активностью, зарегистрированной внеклеточно — электрокардиограммой.
ПЕЙСМЕЙКЕРНЫЕ ПОТЕНЦИАЛЫ
МП пейсмейкерных клеток после каждого ПД возвращается к пороговому уровню возбуждения. Этот потенциал, называемый препотенциалом (пейсмейкерным потенциалом) — триггер для следующего потенциала (рис. 23–6А). На пике каждого ПД после деполяризации возникает калиевый ток, приводящий к запуску процессов реполяризации. Когда калиевый ток и выход ионов K+ уменьшаются, мембрана начинает деполяризоваться, формируя первую часть препотенциала. Открываются Ca2+‑каналы двух типов: временно открывающиеся Ca2+в‑каналы и длительно действующие Ca2+д‑каналы. Кальциевый ток, идущий по Ca2+в‑каналам, образует препотенциал, кальциевый ток в Ca2+д‑каналах создаёт ПД.

Рис. 23–6. РАСПРОСТРАНЕНИЕ ВОЗБУЖДЕНИЯ ПО СЕРДЦУ. А. Потенциалы пейсмейкерной клетки. IK, ICaд, ICaв — ионные токи, соответствующие каждой части пейсмейкерного потенциала. Б–Е. Распространениеэлектрической активности в сердце. 1 — синусно-предсердный узел. 2 — предсердно-желудочковый (АВ) узел.
· ПД в синусно-предсердном и АВ-узлах создаются главным образом ионами Ca2+ и некоторым количеством ионов Na+. У этих потенциалов отсутствует фаза быстрой деполяризации перед фазой плато, которая имеется в других частях проводящей системы и в волокнах предсердия и желудочков.
· Стимуляция парасимпатического нерва, иннервирующего ткани синусно-предсердного узла, гиперполяризует мембрану клеток и тем самым уменьшает скорость возникновения препотенциала действия. Ацетилхолин, выделяемый нервными окончаниями, открывает специальные ацетилхолин–зависимые K+‑каналы в пейсмейкерных клетках, повышая проницаемость мембраны для ионов K+ (что увеличивает положительный заряд наружной стороны клеточной мембраны и ещё больше усиливает отрицательный заряд внутренней стороны клеточной мембраны) Кроме того, ацетилхолин активирует мускариновые M2-рецепторы, что приводит к понижению уровня цАМФ в клетках и замедлению открытия медленных Ca2+‑каналов в период диастолы. В результате замедляется скорость спонтанной диастолической деполяризации. Необходимо учитывать, что сильная стимуляция блуждающего нерва (например, при массаже каротидного синуса) может на некоторое время полностью останавливать процессы генерации импульсов в синусно-предсердном узле.
· Стимуляция симпатических нервов ускоряет деполяризацию и увеличивает частоту генерирования ПД. Норадреналин, взаимодействуя в том числе с b1‑адренорецепторами, повышает внутриклеточное содержание цАМФ, открывает Ca2+д‑каналы, увеличивает ток ионов Ca2+ в клетку и ускоряет спонтанную диастолическую деполяризацию (фазу 0 ПД).
· Частота разрядов синусно-предсердного и АВ-узлов подвержена влиянию температуры и различных биологически активных веществ (например, повышение температуры увеличивает частоту разрядов).
РАСПРОСТРАНЕНИЕ ВОЗБУЖДЕНИЯ ПО СЕРДЕЧНОЙ МЫШЦЕ
Деполяризация, возникающая в синусно-предсердном узле, распространяется радиально по предсердиям и затем сходится (конвергирует) в АВ-соединении (рис. 23–6). Деполяризация предсердий полностью завершается в течение 0,1 с. Так как проведение в АВ-узле происходит медленнее по сравнению с проведением в миокарде предсердий и желудочков (табл. 23–2), возникает предсердно-желудочковая (АВ-) задержка длительностью 0,1 с, после которой возбуждение распространяется на миокард желудочков. Продолжительность предсердно-желудочковой задержки сокращается при стимуляции симпатических нервов сердца, тогда как под влиянием раздражения блуждающего нерва её длительность увеличивается.
Таблица 23–2. Скорость проведения возбуждения (м/с) в тканях сердца
Ткань |
Скорость |
Синусовый узел |
0,05 |
Миокард предсердий |
1 |
АВ-узел |
0,05 |
Пучок Хиса |
1 |
Система волокон Пуркинье |
4 |
Миокард желудочков |
1 |
От основания межжелудочковой перегородки волна деполяризации с большой скоростью распространяется по системе волокон Пуркинье ко всем частям желудочка в течение 0,08–0,1 с. Деполяризация миокарда желудочка начинается с левой стороны межжелудочковой перегородки и распространяется прежде всего вправо сквозь среднюю часть перегородки. Затем волна деполяризации проходит по перегородке вниз к верхушке сердца. Вдоль стенки желудочка она возвращается к АВ-узлу, переходя с субэндокардиальной поверхности миокарда на субэпикардиальную.
Пучок Хиса. Кардиомиоциты этого пучка проводят возбуждение от АВ-соединения к волокнам Пуркинье. Проводящие кардиомиоциты пучка Хиса входят также в состав синусно-предсердного и предсердно-желудочкового узлов.
Волокна Пуркинье. Проводящие кардиомиоциты волокон Пуркинье — самые крупные клетки миокарда. Кардиомиоциты волокон Пуркинье не имеют Т-трубочек и не образуют вставочных дисков. Они связаны с помощью десмосом и щелевых контактов. Последние занимают значительную площадь контактирующих клеток, что обеспечивает наиболее высокую скорость проведения возбуждения по миокарду желудочков.
НАРУШЕНИЯ АВТОМАТИЗМА И ПРОВОДИМОСТИ
· Патология синусно-предсердного узла
à Синусовая брадикардия может быть физиологической (например, у тренированных спортсменов) и патологической. При снижении ЧСС до 35 в минуту может произойти потеря сознания, что опасно возникновением различных осложнений (вплоть до летального исхода).
à Синдром слабости синусно-предсердного узла — нарушение образования импульсов в синусно-предсердном узле, что приводит к брадикардии и длительным паузам в его работе. Клинически синдром проявляется брадикардией и обмороками.
à Остановка синусно-предсердного узла — прекращение генерации импульсов. Пауза, превышающая 10–20 с, ведёт к потере сознания — развивается гипоксия головного мозга, что сопровождается судорожным синдромом (синдромом Морганьи–Адамса–Стокса).
· Патология АВ-узла. Блокаду АВ-узла обозначают термином «АВ-блокада». При ней в разной степени затрудняется проведение возбуждения к пучку Хиса и сократительному миокарду. При крайне выраженной АВ-блокаде (полном прекращении АВ-проведения) предсердия и желудочки сокращаются каждые в своём ритме: для предсердий водителем ритма выступает синусно-предсердный узел, а для желудочков — АВ-соединение. Полная АВ-блокада ввиду редкого ритма сокращения желудочков также может приводить к обморокам, во время которых возможен летальный исход. Причины АВ-блокад — инфаркт миокарда, миокардит; иногда причину поражения проводящей системы установить не удаётся (идиопатическая АВ-блокада). Кроме того, блокада может наступить вследствие применения препаратов, оказывающих отрицательный дромотропный эффект на проводящую систему (сердечные гликозиды, блокаторы медленных кальциевых каналов и b-адреноблокаторы).
· Блокады ножек пучка Хиса характеризуются полным прекращением проведения возбуждения по левой (одновременно по её передней и задней ветвям) или правой ножке предсердно-желудочкового пучка. Возможно нарушения проведения изолированно по передней или задней ветви левой ножки пучка Хиса.
· Дополнительные проводящие пути (рис. 23–6–1) — аномальные проводящие пути, по которым возбуждение способно распространяться «в обход» нормальной проводящей системы от предсердий к желудочкам. Эти дополнительные проводящие пути не обладают свойством задерживать проведение возбуждения (как это происходит в АВ-соединении), что не только нарушает внутрисердечную гемодинамику (желудочки сокращаются до того, как успеют заполниться кровью из предсердий, для чего и необходима АВ-задержка), но вследствие аномального маршрута распространения возбуждения может привести к серьёзным аритмиям, зачастую представляющим опасность для жизни больного. Так, функционирование дополнительного пути проведения, называемого пучком Кента, обусловливает развитие синдрома Вольффа–Паркинсона–Уайта.
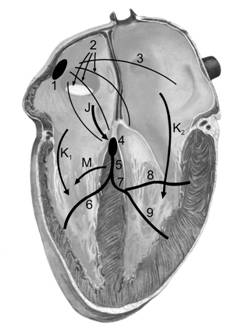
Рис. 23–6–1. Дополнительные проводящие пути сердца [17]. 1 — синусно-предсердный узел, 2 — межузловые проводящие пути, 3 — пучок Бахмана, 4 — АВ-соединение, 5 — пучок Хиса, 6 — правая ножка пучка Хиса, 7 — левая ножка пучка Хиса, 8 — передняя ветвь левой ножки пучка Хиса, 9 — задняя ветвь левой ножки пучка Хиса; К1 и К2 — пучки Кента, J — пучок Джеймса, М — пучок Махейма
à Бахмана пучок начинается от синусно‑предсердного узла, часть волокон расположена между предсердиями (межпредсердный пучок к ушку левого предсердия), часть волокон направляется к предсердно‑желудочковому узлу (передний межузловой тракт).
à Венкебаха пучок начинается от синусно‑предсердного узла, его волокна направляются в левое предсердие и к предсердно‑желудочковому узлу (средний межузловой тракт).
à Джеймса пучок соединяет одно из предсердий с АВ-соединением или проходит внутри этого соединения, по этому пучку возбуждение может преждевременно распространиться на желудочки. Пучок Джеймса важен для понимания патогенеза синдрома Лауна–Генона–Ливайна. Более быстрое распространение импульса при этом синдроме через дополнительный проводящий путь приводит к укорочению интервала PR (PQ), однако расширения комплекса QRS нет, поскольку возбуждение распространяется от АВ-соединения обычным путём.
à Кента пучок — дополнительное предсердно-желудочковое соединение — аномальный пучок между левым предсердием и одним из желудочков. Этот пучок играет важную роль в патогенезе синдрома Вольффа–Паркинсона–Уайта. Более быстрое распространение импульса через этот дополнительный проводящий путь приводит к: 1) укорочению интервала PR (PQ); 2) более раннему возбуждению части желудочков — возникает волна D, обусловливающая расширение комплекса QRS.
à Махейма пучок (атриофасцикулярный тракт). Патогенез синдрома Махейма объясняется наличием дополнительного проводящего пути, связывающего пучок Хиса с желудочками. При проведении возбуждения через пучок Махейма импульс распространяется через предсердия к желудочкам обычным путём, а в желудочках часть их миокарда возбуждается преждевременно в связи с наличием дополнительного проводящего пути. Интервал PR (PQ) при этом нормальный, а комплекс QRS уширен из-за волны D.
· Гетеротопические очаги возбуждения — участки миокарда, генерирующие возбуждение и подавляющие активность (временно на одно сокращение или постоянно) нормального водителя ритма (синусно-предсердного узла). В итоге сокращение всего сердца инициируется именно этим активным участком миокарда, выступающим гетеротопическим водителем ритма.
à Экстрасистола — преждевременное (внеочередное) сокращение сердца, инициированное возбуждением, исходящим из миокарда предсердий, AВ-соединения или желудочков. Экстрасистола прерывает доминирующий (обычно синусовый) ритм. Во время экстрасистолы пациенты обычно ощущают перебои в работе сердца.
à Пароксизмальная тахикардия — внезапно начинающиеся и внезапно прекращающиеся приступы тахикардии — возникает в результате активности гетеротопических очагов автоматизма или (чаще) патологической циркуляции волны возбуждения по миокарду (соответственно пароксизмальная тахикардия может быть предсердной, АВ-узловой и желудочковой). Желудочковая пароксизмальная тахикардия возникает при наличии гетеротопического очага автоматизма в желудочках сердца и/или при патологической циркуляции волны возбуждения по миокарду.
СОКРАТИМОСТЬ
Свойство сократимости миокарда обеспечивает контрактильный аппарат кардиомиоцитов, связанных в функциональный синцитий при помощи ионопроницаемых щелевых контактов. Это обстоятельство синхронизирует распространение возбуждения от клетки к клетке и сокращение кардиомиоцитов. Увеличение силы сокращения миокарда желудочков —положительный инотропный эффект катехоламинов — опосредовано b1‑адренорецепторами (через эти рецепторы действует также симпатическая иннервация) и цАМФ. Сердечные гликозиды также усиливают сокращения сердечной мышцы, оказывая ингибирующее влияние на Na+,K+‑АТФазу в клеточных мембранах кардиомиоцитов.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Сердечная недостаточность — нарушение способности сердца обеспечивать кровоснабжение органов и тканей в соответствии с их метаболическими потребностями. Наиболее распространённая причина сердечной недостаточности — нарушение сократительной способности миокарда, вследствие чего насосная функция сердца становится недостаточной. Другие причины — увеличение постнагрузки (т.е. сердцу приходится перекачивать кровь из сердца в аорту и лёгочные артерии с большими усилиями из-за затруднения кровотока «после сердца»), изменения преднагрузки (т.е. на нагрузка на сердце возрастает и ему приходится больше работать из-за увеличения, например, притока крови к сердцу и увеличения в нём давления в диастолу — нагрузка увеличивается «перед сердцем»). Сердечная недостаточность — «конечная точка» любого заболевания сердца. Практически любой кардиологический больной имеет сердечную недостаточность различной степени выраженности.
Сердечная недостаточность на ранних этапах обычно затрагивает только один круг кровообращения — большой или малый.
· При поражении левых отделов сердца возникающая левожелудочковая сердечная недостаточность будет характеризоваться застоем по малому кругу кровообращения. Застой приводит к повышению давления в сосудах лёгких — лёгочной гипертензии. Первое и наиболее распространённое клиническое проявление — одышка при физической нагрузке. Самые тяжёлые и опасные проявления левожелудочковой сердечной недостаточности — отёк лёгких (вследствие избытка крови «до левых отделов сердца») и кардиогенный шок (вследствие катастрофического недостатка перекачивания крови в большой круг кровообращения).
· При поражении правых отделов сердца возникает правожелудочковая сердечная недостаточность. Она характеризуется застоем крови в большом круге кровообращения (в венозном русле, обладающем значительными возможностями депонирования крови) и клинически характеризуется отёками, увеличением печени, набуханием вен шеи.
· При максимально выраженной сердечной недостаточности (особенно в её терминальную стадию) застойные явления возникают в обоих кругах кровообращения.
Снижение сократительной способности может быть обусловлено следующими причинами.
· Инфаркт миокарда — некроз участка сердечной мышцы, соответственно с потерей его способности к сокращению.
à В острую стадию инфаркта миокарда снижение сократительной способности выражено в максимальной степени (исчезает сократимость некротизированной ткани и существенно снижается сократимость близрасположенных участков миокарда), что при вовлечении более 50% миокарда левого желудочка приводит к острой сердечной недостаточности — кардиогенному шоку и отёку лёгких.
à В рубцовую стадию инфаркта миокарда замещение поражённой части стенки желудочков соединительной тканью также обусловливает снижение сократительных свойств миокарда. При нефункционировании значительной части миокарда развивается сердечная недостаточность, теперь уже имеющая хронический характер.
· Врождённые и приобретённые пороки сердца приводят: 1) к перегрузке полостей сердца давлением или объёмом; 2) к гипертрофии миокарда различных камер сердца. В этих условиях сократимость миокарда снижается, что в сочетании с увеличением пред- и постнагрузки результируется развитием сердечной недостаточности.
· Артериальная гипертензия. Многие больные с гипертонической болезнью или симптоматическими артериальными гипертензиями страдают сердечной недостаточностью. Причины — увеличение постнагрузки (сердцу приходится перекачивать кровь против повышенного системного давления) и относительная коронарная недостаточность вследствие развития гипертрофии миокарда. Кроме того, важен диастолический компонент сердечной недостаточности — во время диастолы нарушены процессы расслабления миокарда (миокард не расслабляется в той же степени, как у здорового человека), что нарушает возможности полноценного выброса крови из сердца в систолу. Снижение сократительной способности миокарда характерно для стойкой тяжёлой артериальной гипертензии, быстро приводящей к развитию сердечной недостаточности.
· Токсические кардиомиопатии (алкоголь, кобальт, катехоламины, доксорубицин), врождённые, инфекционные, при поражениях сердца на фоне системных заболеваний соединительной ткани и др. также нарушают сократимость и расслабление миокарда
