
- •27. Ферментный катализ. Темп. РН.
- •29. Уровни регуляция активности ферментов
- •31. Мед. Эмзимология
- •32. Витамины, общее понятие.
- •33. Водорастворимые витамины
- •34 Водорастворимые витамины
- •35. Жирорастворимые вит.
- •36 Гормоны.Общее понятие.
- •38.Гормоны гопофиза и гипотал.
- •39 Гормоны щитовидной железы
- •40. Половые гормоны.
- •42. Гормоны мозгового вещества надпочечников
- •44. Гормоны местного действия
- •45. Биологические мембраны.
- •46. Трансмембранные переносы
- •47. Свободно-радикальные замещения.
- •48. Антиоксидантная система
- •49. Энергитический обмен
- •51. Хемиоосматическая теория.
- •53. Окислительное декарб. Пвк
- •54. Цикл трикарбоновых кислот
- •56. Основные углеводы.
- •62. Физиологически важные липиды
- •78. Катаболизм амино кислот
- •82. Нуклеиновых кислот
51. Хемиоосматическая теория.
Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов. Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии ≪обслуживается≫ соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окислительно-восстановительным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи. Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника
электронов, является движущей силой для образования АТФ и других видов полезной биологической энергии. Механизмы этих превращений описывает хемиосмотическая концепция превращения энергии в живых клетках. Она была выдвинута П. Митчеллом в 1960 г. для объяснения молекулярного механизма сопряжения транспорта электронов и образования АТФ в дыхательной цепи. Согласно хемиосмотической концепции, движение электронов по дыхательной цепи является источником энергии для транслокации протонов через митохондриальную мембрану. Возникающая при этом разность
электрохимических потенциалов (ΔμH+) приводит в действие АТФ-синтазу,
катализирующую реакцию.
Эффективность окислительного фосфорилирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О (коэффициент фосфорилирования). Экспериментально определяемые значения Р/О, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфорилированием. Действительно, окислительное фосфорилирование в отличие от субстратного не является процессом,
в котором окисление жестко сопряжено с образованием макроэргов. Степень
сопряжения зависит главным образом от целостности митохондриальной мембра-
ны, сберегающей разность потенциалов, создаваемую транспортом электронов. По
этой причине соединения, обеспечивающие протонную проводимость (как 2,4-ди-
нитрофенол), являются разобщителями. В норме скорость митохондриального транспорта электронов регулируется
содержанием АДФ. Выполнение клеткой функций с затратой АТФ приводит
к накоплению АДФ, который в свою очередь активирует тканевое дыхание. Таким
образом, клеткам свойственно реагировать на интенсивность клеточного метаболизма и поддерживать запасы АТФ на необходимом уровне. Это свойство называется дыхательным контролем.
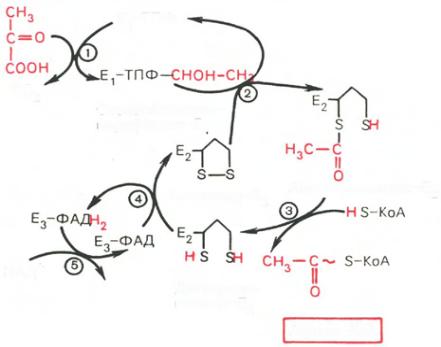
53. Окислительное декарб. Пвк
Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название ≪пируватдегидрогеназный комплекс≫. На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия тиаминпирофосфатом (ТПФ)
в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидролипоилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением. На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-
липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+.
Процесс окислительного декарбоксилирования пирувата происходит
в матриксе
митохондрий. В нем принимают участие
(в составе сложного мультиферментного
комплекса) 3 фермента (пируватдегидрогеназа,
дигидролипоилацетилтрансфераза,
дигидролипоилдегидрогеназа) и 5
коферментов (ТПФ, амид липоевой кислоты,
коэнзим А, ФАД и НАД)
Суммарную реакцию: Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.
