
- •27. Ферментный катализ. Темп. РН.
- •29. Уровни регуляция активности ферментов
- •31. Мед. Эмзимология
- •32. Витамины, общее понятие.
- •33. Водорастворимые витамины
- •34 Водорастворимые витамины
- •35. Жирорастворимые вит.
- •36 Гормоны.Общее понятие.
- •38.Гормоны гопофиза и гипотал.
- •39 Гормоны щитовидной железы
- •40. Половые гормоны.
- •42. Гормоны мозгового вещества надпочечников
- •44. Гормоны местного действия
- •45. Биологические мембраны.
- •46. Трансмембранные переносы
- •47. Свободно-радикальные замещения.
- •48. Антиоксидантная система
- •49. Энергитический обмен
- •51. Хемиоосматическая теория.
- •53. Окислительное декарб. Пвк
- •54. Цикл трикарбоновых кислот
- •56. Основные углеводы.
- •62. Физиологически важные липиды
- •78. Катаболизм амино кислот
- •82. Нуклеиновых кислот
физико-химическими свойствами белков являются
высокая вязкость растворов, незначительная диффузия, способность к набу-
ханию в больших пределах, оптическая активность, подвижность в электри-
ческом поле, низкое осмотическое давление и высокое онкотическое давле-
ние, способность к поглощению УФ-лучей при 280 нм (это свойство,
обусловленное наличием в белках ароматических аминокислот, использует-
ся для количественного определения белков).
Белки, как и аминокислоты, амфотерны благодаря наличию свободных
NH2- и СООН-групп. Для них характерны все свойства кислот и оснований.
В зависимости от реакции среды и соотношения кислых и основных
аминокислот белки в растворе несут или отрицательный, или положитель-
ный заряд, перемещаясь к аноду или катоду. Это свойство используется при
очистке белков методом электрофореза.
Белки обладают явно выраженными гидрофильными свойствами. Раст-
воры белков имеют очень низкое осмотическое давление, высокую вязкость
и незначительную способность к диффузии. Белки способны к набуханию
в очень больших пределах. С коллоидным состоянием белков связан ряд
характерных свойств, в частности явление светорассеяния, лежащее в основе
количественного определения белков методом нефелометрии. Этот эффект
используется, кроме того, в современных методах микроскопии биологи-
ческих объектов. Молекулы белка не способны проникать через полупрони-
цаемые искусственные мембраны (целлофан, пергамент, коллодий),
изоионная точки белков
В изоэлектрической точке суммарный заряд белков, обладающих амфотер-
ными свойствами, равен нулю и белки не перемещаются в электрическом
поле. Зная аминокислотный состав белка, можно приближенно определить
изоэлектрическую точку (pI); pI является характерной константой белков.
Изоэлектрическая точка большинства белков животных тканей лежит в пре-
делах от 5,5 до 7,0, что свидетельствует о частичном преобладании кислых а.к.
Вторичная структура белка
Под вторичной структурой белка подразумевают конфигурацию поли-
пептидной цепи, т. е. способ свертывания, скручивания (складывание, упа-
ковка) полипептидной цепи в спиральную или какую-либо другую конфор-
мацию. Процесс этот протекает не хаотично, а в соответствии с програм-
мой, заложенной в первичной структуре. Подробно изучены две основные
конфигурации полипептидных цепей, отвечающих структурным требова-
ниям и экспериментальным данным: α-спирали и β-структуры.
Водородная связь представляет собой слабое электростатическое
притяжение (взаимодействие, связь) между одним электроотрицательным
атомом (например, кислородом или азотом) и водородным атомом, кова-
лентно связанным со вторым электроотрицательным атомом.
Другой тип конфигурации полипептидных цепей, обнаруженный в бел-
ках волос, шелка, мышц и в других фибриллярных белках, получил
название β-структуры. В этом случае две или более линейные полипеп-
тидные цепи, расположенные параллельно или, чаще, антипараллельно,
прочно связываются межцепочечными водородными связями между NH-
и СО-группами соседних цепей, образуя структуру типа складчатого слоя
В природе существуют белки, строение которых, однако, не соответст-
вует ни β-, ни α-структуре. Типичным примером таких белков является
коллаген – фибриллярный белок, составляющий основную массу соедини-
тельной ткани в организме человека и животных.
Под третичной структурой белка подразумевают пространственную ориен-
тацию полипептидной спирали или способ укладки полипептидной цепи
в определенном объеме.
глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700,
содержащий 153 аминокислотных остатка (полностью выяснена первичная
структура), представленный одной полипептидной цепью. Основная функ-
ция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-
глобина (рис. 1.20) представлена в виде изогнутой трубки, компактно
уложенной вокруг гема (небелковый компонент, содержащий железо;
связям относятся водородные
связи, электростатические взаимодействия заряженных групп, межмолеку-
лярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых ра-
дикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
Под четвертичной структурой подразумевают способ укладки в простран-
стве отдельных полипептидных цепей, обладающих одинаковой (или раз-
ной) первичной, вторичной или третичной структурой, и формирование
единого в структурном и функциональном отношениях макромолекулярного образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а нековалентными (аналогичными тем, которые обеспечивают стабильность тре-
тичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы. Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными
молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер.
Природные пептиды.
В соответствии с функ-
циональным принципом различают 12 главных классов белков: 1) катали-
тически активные белки (ферменты); 2) белки-гормоны (хотя есть и сте-
роидные гормоны); 3) белки-регуляторы активности генома; 4) защитные
белки (антитела, белки свертывающей и антисвертывающей систем крови);
5) токсические белки; 6) транспортные белки; 7) мембранные белки; 8) со-
кратительные белки; 9) рецепторные белки; 10) белки-ингибиторы ферментов.
повысился интерес к структуре и функциям
встречающихся в свободном состоянии в организме низкомолекулярных
пептидов, выполняющих ряд специфических биологических функций. Ко-
роткие пептиды, содержащие до 10 аминокислот, принято называть
олигопептидами; в то же время полипептиды и белки считаются
взаимозаменяемыми, хотя термином ≪полипептиды≫ чаще обозначают
продукты с мол. м. менее 10000.
Природные пептиды, наделенные биологической активностью, в зависи-
мости от характера действия и происхождения принято делить на 4 группы:
1) пептиды, обладающие гормональной активностью (вазопрессин, окси-
тоцин, кортикотропин, глюкагон, кальцитонин, меланоцитстимулирующий
гормон, рилизинг-факторы гипоталамуса и др.; см. главу 8); 2) пептиды,
принимающие участие в процессе пищеварения (в частности, гастрин
и секретин; см. главу 12); 3) пептиды, источник которых – α2-глобулиновая
фракция сыворотки крови (такие, как ангиотензин, брадикинин и каллидин);
4) нейропептиды
ангиотензины (представленные октапептидами),
оказывающие выраженное сосудосуживающее действие
К группе вазоактивных (оказывающих влияние на тонус сосудов) пепти-
дов относятся, кроме того, широко применяемые в медицинской практике
брадикинин и каллидин
природным пептидам в значительной степени обусловлен
необычно высокой их биологической активностью. Они оказывают мощное
фармакологическое действие на множество физиологических функций орга-
низма. В то же время были замечены низкая стабильность и быстрый
распад их в организме при физиологических значениях рН среды.
Гемопротеины
К группе гемопротеинов относятся гемоглобин и его производные, миогло-
бин, хлорофиллсодержащие белки и ферменты (вся цитохромная система,
каталаза и пероксидаза). Все они содержат в качестве небелкового компо-
нента структурно сходные железо- (или магний)порфирины, но различные
по составу и структуре белки, обеспечивая тем самым разнообразие их
биологических функций. Последний со-
стоит из четырех замещенных пирролов:
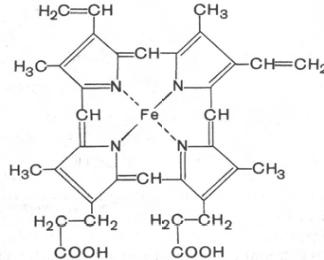
Известен, кроме того, фетальный гемоглобин (гемоглобин
новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух
γ-цепей. Фетальный гемоглобин отличается от HbA1 не только составом
аминокислот, но и физико-химическими свойствами
аномальных гемоглобинов мутантные формы гемоглобинов в крови вследствие мутации генов. Если замена аминокислоты происходит на поверхности
молекулы гемоглобина, то это мутация первого класса; подобные мутации
обычно не сопровождаются развитием тяжелой патологии, и болезнь
протекает бессимптомно; исключение составляет серповидно-клеточная
анемия. При замене аминокислоты вблизи гема нарушается связывании. кислорода – это мутация второго класса, сопровождающаяся развитием
болезни. И наконец, если замена происходит во внутреннем участке
молекулы гемоглобина, говорят о третьем классе мутации; подобные
мутации приводят к нарушению пространственной структуры
Болезни гемоглобинов (их насчитывают более 200) называют гемогло-бинозами. Принято делить их на гемоглобинопатии, в основе развития
которых лежит наследственное изменение структуры Классическим примером наследственной гемоглобинопатии является
серповидно-клеточная анемия, широко распространенная в странах
Южной Америки, Африки.
При этой патологии
эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 2.2). Гемоглобин S, как показали Л. Полинг и др.,отличается рядом свойств от нормального гемоглобина: в частности, после
отдачи кислорода в тканях он превращается в плохо растворимую дезоксиформу и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку
и приводят к массивному гемолизу, кодирующей синтез β-цепи гемоглобина Талассемии генетически обусловленное нарушение синтеза одной из нормальных цепей
гемоглобина. Если угнетается синтез β-цепей, то развивается β-талассемия; при генетическом дефекте синтеза α-цепей развивается α-талассемия. При β-талассемии в крови наряду с HbA1 появляется до 15% НЬА2
и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется
гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму.
Флавопротеины
Флавопротеины содержат прочно связанные с белком простетические груп-
пы, представленные изоаллоксазиновыми производными – окисленными
флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД).
Флавопротеины входят в состав оксидоредуктаз – ферментов, катализи-
рующих окислительно-восстановительные реакции в клетке. Некоторые
Флавопротеины содержат ионы металлов. Типичными представителями
флавопротеинов, содержащих также негемовое железо, являются ксантин-
оксидаза, альдегидоксидаза, СДГ, дигидрооротатдегидрогеназа, ацил-
КоА-дегидрогеназа и транспортирующий электроны флавопротеин. На
долю двух последних приходится до 80% митохондриальных флавопро-
85
теинов, выполняющих важную роль в биоэнергетике клетки (см. главу 9).
Негемовое железо связывается с белковым компонентом, отличающимся от
гемсодержащих хромопротеинов. Железо ковалентно связано с атомом
серы остатка цистеина в белке. При кислотном гидролизе такого белка
освобождается железо и H2S. Несмотря на структурные отличия от цито-
хромов, негемовые флавопротеины выполняют аналогичную функцию в
транспорте электронов благодаря способности переходить из окисленного
в восстановленное состояние.
Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние
рассматриваются как простетические группы. В природе обнаружено 2 типа
нуклеопротеинов, отличающихся друг от друга по составу, размерам
и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и
рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только
природу углеводного компонента (пентозы), входящего в состав нуклеино-
вых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой
ДНК хранит наследственную информацию. Подтверждением этого слу-
жит явление трансформации, наблюдаемое у бактерий и открытое также
в культуре клеток человека. Сущность явления заключается в превращении
одного генетического типа клеток в другой путем изменения природы ДНК. Гистоновые и не гистоновые белки.
ЛИПОПРОТЕИНЫ
Этот класс сложных
белков состоит из белка и простетической группы, представленной каким-либо липидом. В частности, в составе липопротеинов открыты нейтральные
жиры, свободные жирные кислоты, фосфолипиды, холестериды. Липо-
протеины широко распространены в природе: в растениях, тканях живот-
ных и у микроорганизмов – и выполняют разнообразные биологические
функции. Они входят в состав клеточной мембраны и внутриклеточных
биомембран ядра, митохондрий, микросом (структурированные липопро-
теины), а также присутствуют в свободном состоянии (главным образом
в плазме крови). К липопротеинам относятся, кроме того, тромбопластический белок ткани легких, липовителлин желтка куриного яйца, некоторые
фосфолипиды молока и т.д. Установлено, что липопротеины участвуют
в структурной, комплексной организации миелиновых оболочек, нервной
ткани, хлоропластов, фоторецепторной и электронно-транспортной систем,
палочек и колбочек сетчатки и др.
Большинство ЛП синтезируется в печени или в слизистой оболочке
кишечника. Они содержат гидрофобное липидное ядро, окруженное поляр-
ными липидами и оболочкой из белков, получивших название апобелки.
ФОСФОПРОТЕИНЫ
К белкам этого класса относятся казеиноген молока, в котором содержание
фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб. особенностью
структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина.
На одну молекулу белка обычно приходится
2–4 остатка фосфата.

Следует отметить, что
фосфопротеины содержат органически связанный, лабильный фосфат, аб-
солютно необходимый для выполнения клеткой ряда биологических функ-
ций. Кроме того, они являются ценным источником энергетического и
пластического материала в процессе эмбриогенеза и дальнейшего постна-
тального роста и развития организма.
протеогликаны, состоя-
щие из белка и гликозаминогликанов (прежнее название мукополиса-
хариды); последние состоят из цепей сложных углеводов: аминосахаров,
уроновых кислот, серной кислоты и отдельных моносахаридов. Типичными
гликозаминогликанами являются гиалуроновая кислота, хондроитинсерная
кислота и гепарин, химический состав, структура. К типичным гликопротеинам относят большинство белковых гормонов,
секретируемые в жидкие среды организма вещества, мембранные сложные
белки, все антитела (иммуноглобулины), белки плазмы крови, молока,
овальбумин, интерфероны, факторы комплемента, группы крови, рецеп-
торные белки и др. Из этого далеко не полного перечня гликопротеинов
видно, что все они выполняют специфические функции: обеспечивают
клеточную адгезию, молекулярное и клеточное узнавание, антигенную
активность опухолевых клеток, оказывают защитное и гормональное,
а также антивирусное действие.
Интерфероны. Интерфероны – это ингибиторы размножения многих ти-
пов вирусов. Они образуются в клетке в ответ на внедрение вирусной нуклеиновой кислоты, ограничивая вирусную агрессию
(инфекцию). Иммуноглобулины, или антитела, также относятся
к классу гликопротеинов, выполняют защитную функцию, обезвреживая
поступающие в организм чужеродные вещества – антигены любой хими-
ческой природы. Синтезируются иммуноглобулины плазматическими клет-
ками, образовавшимися из лимфоцитов. других гликопротеинов, выполняющих ряд важнейших биологи-
ческих функций, следует отметить все белки плазмы крови (за исключением
альбуминов), трансферрин, церулоплазмин, гонадотропный и фолликуло-
стимулирующие гормоны, некоторые ферменты, а также гликопротеины
в составе слюны (муцин), хрящевой и костной тканей и яичного белка
(овомукоид).
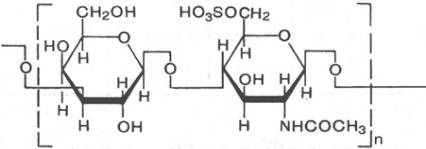
Гликозамино гликаны.
Гиалуроновая кислота
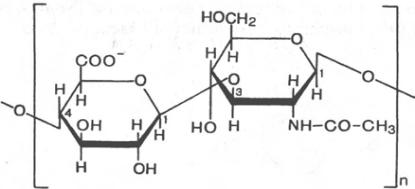
β-Глюкуроновая к-та N -ацетилглюкозамин
Хондроитин-4-сульфат
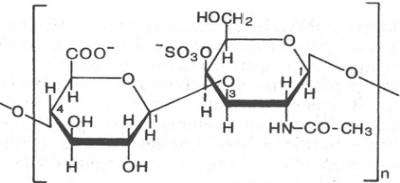
β-Глюкуроновая к-та N-ацетилгалактоз-
аминсульфат
Гепарин
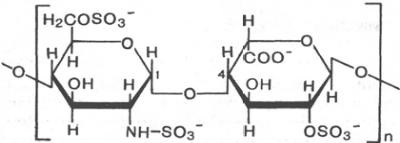
Сульфатированный Сульфатированная
Глюкозамин идуроновая кислота
Кератансульфат
Остаток Остаток
D-галактозы N-ацетилглюкозамин-
-6-сульфата
Дерматансульфат
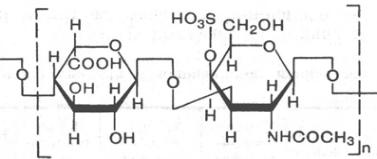
Остаток Остаток
L-идуроновой к-ты N-ацетилгалактозамин-
-4-сульфата
МЕТАЛЛОПРОТЕИНЫ
К металлопротеинам относятся биополимеры, содержащие, помимо белка,
ионы какого-либо одного металла или нескольких металлов Типичными представителями первых являются железосодержащие белки ферритин, трансферрин и гемосидерин. Ферритин – высокомолекулярный водорастворимый белок с мол. массой 400000, в котором содержание железа составляет от 17 до 23% (в среднем 20%). Он сосредоточен главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Железо в ферритине находится в окис-
ленной форме. Fe2+, Fe3+ - Транспорт О2, СО2,транспорт электронов
(окислительно-восстановительные реакции),
транспорт и депонирование железа, восстановление N2 в NH3
Cu+, Cu2+= Окисление, депонирова-
ние и транспорт меди
K+, Na+, Mg2+, Ca2+- Транспорт и осво-
бождение фосфатных групп
Трансферрин – растворимый в воде железопротеин (мол. масса
90000), гликопротеин, обнаруживаемый главным образом в сывороткекрови в составе β-глобулинов. Молекула трансфер-
рина содержит 2 атома железа; трансферрин служит физиологическим
переносчиком железа в организмею
НУКЛЕИНОВЫХ КИСЛОТ
ДНК: Н3РO4 Дезоксирибоза
Аденин Гуанин Цитозин
Тимин
РНК: Н3РO4 Рибоза Аденин Гуанин
Цитозин Урацил
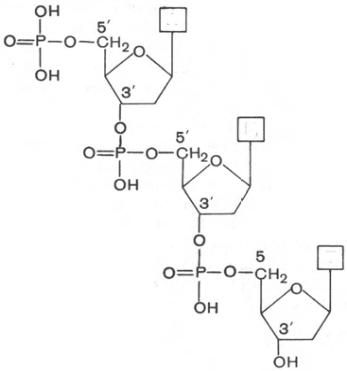
Под первичной структурой нуклеиновых кислот понимают порядок, после-
довательность расположения мононуклеотидов в полинуклеотидной цепи
ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями.
последовательности ДНК:
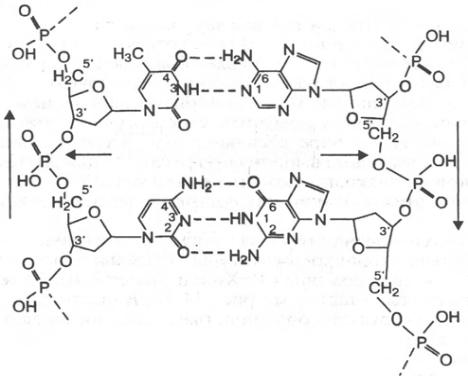
Вторичная структура нуклеиновых кислот
ДНК состоит из двух цепей, образуя правовращающую спираль, в которую обе полинуклеотидные цепи закручены вокруг однойи той же оси. Удерживаются цепи благодаря водородным связям, образующимся между их азотистыми основаниями (рис. 3.1). Обе цепи поли-
нуклеотидов в биспиральной молекуле ДНК имеют строго определенное пространственное расположение, при котором азотистые основания находятся внутри, а фосфорильные и углеводные компоненты – снаружи
РНК
РНК
первичная структура большинства тРНК, последовательность всех или почти всех природных тРНК как будто бы укладывается в эту схему ≪клеверного листа≫
Во всех тРНК есть участки, взаимодействующие с рибосомами,
места для связывания с аминокислотами и ферментами, а также специфическая последовательность трех нуклеотидов (триплет), называемая антикодоном
Ферменты
Ферменты обеспечивают осуществление таких важнейших процессов жизнедеятельности, как экспрессия (реализация) наследственной информации, биоэнергетика, синтез и распад биомолекул (обмен веществ) От неорганических катализаторов ферменты отличаются рядом харак-
терных особенностей. Прежде всего ферменты чрезвычайно эффективны
и проявляют в миллионы и миллиарды раз более высокую каталитическую
активность в условиях умеренной температуры (температура тела), нор-
мального давления и в области близких к нейтральным значениям рН
среды. Ферменты отличаются высокой специфичностью действия в отношении
как химической природы субстрата, так и типа реакции, т.е. каждый фермент катализирует в основном только определенную химическую реакцию. Для каждого фермента характерны специфическая последовательность расположения аминокислотных остатков и пространственная конформация.
ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ
В настоящее время получены неопровержимые экспериментальные дока-
зательства белковой природы ферментов
При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию.
Ферменты при гидролизе, как и белки, распадаются на аминокислоты,
что, бесспорно, служит веским доказательством белковой природы ферментов. Ферменты, как и все белки, обладают рядом свойств, характерных для
высокомолекулярных соединений: амфотерностью (могут существовать
в растворе в виде анионов, катионов и амфионов); электрофоретической
подвижностью благодаря наличию в них положительных и отрицательных
зарядов, а в изоэлектрической точке не обнаруживают подвижности в
электрическом поле. Ферменты оказывают высокоспецифическое действие, что также доказывает их белковую природу, поскольку белки в иммунологическом отношении отличаются крайне высокой специфичностью. константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической
группы, рассматривающейся как интегральная часть молекулы фермента.
Полипептидную часть фермента принято называть апоферментом. Под коферментом часто подразумевают дополнительную группу, легко отделяемую от апофермента при диссоциации. Предполагают, что
простетическая группа может быть связана с белком ковалентными и нековалентными связями. витамины В1, В2, В6, РР, содержащие коферменты.
25. Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по
физическим и химическим свойствам, в частности по сродству к субстрату,
максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам. Одним из наиболее изученных 4 ферментов, множественность форм которого детально изучена методом гель-электрофореза, является ЛДГ, катализирующая обратимое превращение пировиноградной кислоты в молочную. Пять изоферментов ЛДГ образуютсяиз 4 субъединиц примерно
одинакового размера, но двух разных типов. Поскольку Н-протомеры несут более выраженный отрицательный заряд при рН 7,0–9,0, чем М-протомеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электрофорезе будет мигрировать с наибольшей скоростью в электрическом поле к положительному электроду (аноду). изоферменты ЛДГ, обладая почти одинаковой ферментативной активностью, различаются некоторыми физико-химическими свойствами: молекулярной массой, электрофоретической подвижностью, отношением к активаторам и ингибиторам и др., однако для каждой ткани в норме характерно свое соотношение форм
МУЛЬТИМОЛЕКУЛЯРНЫЕ ФЕРМЕНТНЫЕ СИСТЕМЫ ферментные комплексы, в состав которых входят не субъединицы а раз-
ные ферменты, катализирующие последовательные ступени превращения
какого-либо субстрата. Отличительными особенностями подобных мультиферментных комплексов являются прочность ассоциации ферментов
и определенная последовательность прохождения промежуточных стадий
во времени, обусловленная порядком расположения каталитически активных (различных) белков в пространстве Типичными примерами подобных мультиферментных комплексов являются пируватдегидрогеназа и кетоглутаратдегидрогеназа, катализирующие соответственно окислительное декарбоксилирование пировиноградной и αкетоглутаровой кислот в животных тканях
Ферментный катализ.
фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации
субстрата на скорость реакции. В процессе реакции различают несколько стадий: присоединение молекулы субстрата к ферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента. Фермент вступает во взаимодействие с субстратом на очень короткий период, поэтому долгое время не удавалось показать образование такого комплекса. В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи (рис. 4.9). Информация о природе связей между субстратом и связывающим участком активного центра фермента. ≪ключ-замок≫.В каталитическом процессе существенное значение имеют точное соот-
ветствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия.
27. Ферментный катализ. Темп. РН.
Ферментативная кинетика занимается исследованием закономерностей влияния
химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является
получение информации, которая может способствовать выяснению молекулярного механизма действия фермента.
Известно, что любая химическая реакция характеризуется константой термодинамического равновесия. Она выражает состояние химического равновесия, достигаемого системой, и обозначается Кр. При высокой концентрации субстрата скорость реакции максимальна,
становится постоянной и не зависящей
от концентрации субстрата [S]
уравнением Михаэлиса–Ментен, выражающее количественное
соотношение между концентрацией субстрата и скоростью ферментативной
![]()
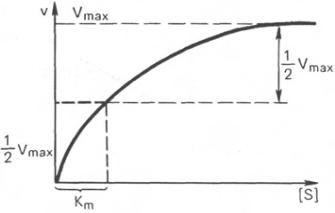
Таким образом, константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции
составляет половину от максимальной
Скорость химических реакций зависит от
температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот.
Зависимость активности ферментов от рН среды. Ферменты обычно
наиболее активны в пределах узкой зоны концентрации водородных ионов,
соответствующей для животных тканей в основном выработанным в процессе эволюции физиологическим значениям рН среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы имеется определенная точка, в которой фермент проявляет максимальную активность; эту точку называют оптимумом рН среды для действия данного фермента.
Ферментативные эффекторы.
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Так, соляная кислота активирует действие пепсина желудочного сока;желчные кислоты повышают активность панкреатической липазы; Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов
Ингибиторы ферментов обычно принято делить на два больших класса: обратимые и необратимые. Это вещества, вызывающие частичное (обратимое) или полное торможение реакций, катализируемых ферментами. К подобным веществам относятся, например, ингибитор трипсина, Иногда ингибитор является составным компонентом предшественника фермента, например пепсина, Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание), приводят к необратимой инактивации фермента.
Типы ингибирования. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается
преодолеть торможение
ферментативной реакции путем увеличения
концентрации субстрата. Конкурентное
ингибирование может быть вызвано
веществами, имеющими структуру, похожую
на структуру субстрата, но несколько
отличающуюся от структуры истинного
субстрата. Такое ингибирование основано
на связывании ингибитора с субстратсвязывающим
(активным) центром. Классическим примером
подобного типа ингибирования является
торможение сукцинатдегидрогеназы (СДГ)
малоновой кислотой. Этот фермент
катализирует окисление путем дегидрирования
янтарной кислоты
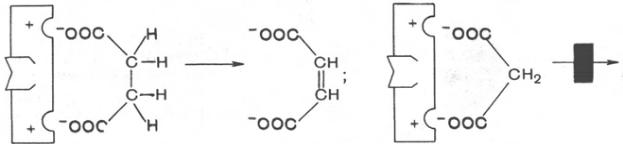 .Сукцинат
Фумарат Малонат
.Сукцинат
Фумарат Малонат
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень
торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым.
