
- •Поверхностная энергия раздела фаз
- •Метод Вильгельми
- •Метод лежачей капли
- •Метод определения по форме висячей капли.
- •Метод вращающейся капли
- •Метод Дю Нуи (метод отрыва кольца).
- •Сталагмометрический, или метод счета капель.
- •Метод максимального давления пузырька (метод Ребиндера).
- •Метод осциллирующей струи
- •Метод стоячих волн
- •Метод бегущих волн
- •Нормируемые показатели пав
- •3) Гидрофильно-липофильный баланс (глб).
- •4) Точка Крафта
- •Факторы адгезионного взаимодействия
- •Молекулярная (адсорбционная) адгезия.
- •Химическая адгезия.
- •Методы определения адгезионной прочности
- •Придание поверхности определенного рельефа,
- •Химическое модифицирование поверхности с формированием активных групп,
- •Создание прочной оксидной пленки на поверхности.
- •2 Абсолютная адсорбция.
- •3 Удельная адсорбция.
- •Уравнение монослойной адсорбции Ленгмюра:
- •Уравнение Никольского.
- •Уравнение изотермы адсорбции теории бэт
- •Уравнение в Ленгмюра вида:
- •Переход электрона с катиона более низкой валентности на катион более высокой валентности
- •Электронные переходы, вызванные дефектами кристаллической структуры
- •Электронные переходы, обуславливающие цвет органических соединений.
- •1 Электрическая проводимость
Переход электрона с катиона более низкой валентности на катион более высокой валентности
Пигменты, в состав которых входят металлы в разных валентных состояниях, всегда интенсивно окрашены. К таким пигментам относятся свинцовый сурик Pb3O4, являющийся свинцовой солью ортосвинцовой кислоты, черный железооксидный пигмент Fe3O4, кристаллическая решетка которого представляет собой кубическую плотную упаковку ионов кислорода, в пустотах которой распределены ионы Fe 2+ и Fe 3+ , железная лазурь KxFey[Fe(CN)6]z.nH2O, которая образует кубическую решетку с ионом K+ в центре, ионы Fe2+ окружены атомами углерода, а ионы Fe3+ - атомами азота. Окраска всех этих соединений обусловлена переходом электрона с иона более низкой валентности на ион более высокой валентности.
В кристалле черного железооксидного пигмента ион Fe2+ находится в октаэдрическом окружении ионов кислорода и имеет конфигурацию внешнего электронного слоя 3s23p63d5. Согласно теории кристаллического поля, основное состояние с пятью d – электронами не расщепляется. Таким образом, в соединении, где имеются ионы Fe 2+ и Fe 3+, есть нерасщепленный уровень, который по энергетическому состоянию располагается между двумя уровнями, получающимися в результате расщепления основного состояния иона Fe 2+ (рисунок ).
е

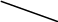



t
Рисунок – Соотношение энергетических состояний уровней, получившихся при расщеплении d - орбиталей в октаэдрическом кристаллическом поле
В этом случае возможен переход электрона не только с уровня t на уровень е, но и на уровень, соответствующий основному состоянию иона Fe3+. Это сильно расширяет полосу поглощения в области видимого света.
В железной лазури ионы Fe 2+ и Fe 3+ находятся в октаэдрическом поле лигандов (углерода и азота, соответственно). Интенсивная синяя окраска этого соединения обусловлена переходом электрона с иона Fe2+ на ион Fe3+.
Электронные переходы, вызванные дефектами кристаллической структуры
Цвет кристаллического вещества может определяться наличием в нем точечных дефектов, которые служат причиной появления добавочных энергетических уровней; соответствующие им электронные переходы могут происходить под действием электромагнитного излучения видимой части спектра. Центром окраски может быть анионная вакансия, которая, действуя как положительный заряд, захватывает свободный электрон, поставляемый каким-либо примесным атомом; такой центр окраски называют F – центром. Центром окраски может являться совокупность катионной вакансии и дырки; такой центр называется V – центром. Могут быть и более сложные центры, состоящие их двух анионных вакансий и электрона или совокупности F -0 центра, катионной и анионной вакансии.
Наличием центров окраски определяется цвет ультрамарина, кристаллическая решетка которого представляет собой решетку алюмосиликата. Эта решетка состоит из общих для двух тетраэдров атомов кислорода и чередующихся атомов кремния и алюминия. Вследствие меньшей валентности алюминия алюмосиликатный каркас заряжен отрицательно, катионы натрия, уравновешивающие отрицательный заряд каркаса, равномерно распределены внутри него. Кроме катионов внутри каркаса содержатся ионы или радикалы серы. Наличие серы в пустотах кристаллической решетки ультрамарина приводит к появлению широкой полосы поглощения в длинноволновой области видимой части спектра.
