
- •Первичная структура белковой молекулы. Характеристика пептидной связи (из пред.)
- •Виды вторичной структуры белковой молекулы. Связи, стабилиз. Втор. Структуру.
- •Классификация простых белков. Основные представители.
- •Классификация сложных белков. Основные представители.
- •69. Переваривание нуклеопротеидов в жкт
- •89. Половые гормоны
- •Ферменты
- •25. Кофермент а – строение и биол. Роль
- •27. Строение и функции ферментов
- •28. Механизм действия ферментов (Еакт, фермент-субстр. Комплекс)
- •33. Виды специфичности ферментов
- •34. Активность ферментов. Ингибирование и активация ферментов
- •35. Классификация и номенклатура ферментов
- •Метаболизм. Дыхательная цепь. Ок. Фосфорелирование
- •36. Метаболизм. Осн. Метаболические пути
- •37. Этапы метаболизма. Пути синтеза атф в организме жив. И чел.
- •38. Биологическое окисление. Тканевое дыхание
- •39. Ферменты тканевого дыхания (над, фад, кофермент q, цитохромы)
- •40. Дыхательная цепь. Окислительное фосфорилирование
- •41. Этапы митохондриальной цепи переноса электронов (дыхательной цепи)
- •42. Образование атф путем окислит. Фосфорилирования
- •Нуклеиновые кислоты: виды, строение, биолог. Св-ва
- •Днк: строение, св-ва, биолог. Роль
- •Рнк: виды, строение, биолог. Роль
- •Нуклеотиды, нуклеозиды
- •57. Желчные кислоты: строение, св-ва, биол. Роль в переваривании липидов
- •63. Холестерол. Строение, биологическая роль
- •64. Синтез холестерина
- •Углеводы
- •43. Классификация и биол. Функции углеводов
- •44. Переваривание углеводов в жкт
- •45. Переваривание клетчатки у жвачных животных
- •46. Синтез и распад гликогена в печени
- •47. Анаэробный распад у/в в тканях. Гликолиз. Энергетический эффект
- •48. Гликогенолиз. Энергетический эффект
- •49. Аэробный распад у/в в тканях. Окислительное декарбоксилирование пвк
- •50. Цикл трикарбоновых кислот. Энергетический эффект
- •52. Энергетика полного окисления глюкозы
- •53. Виды брожения у/в. Применение в пищевом производстве
Ферменты
24. АТФ – строение
и биол. роль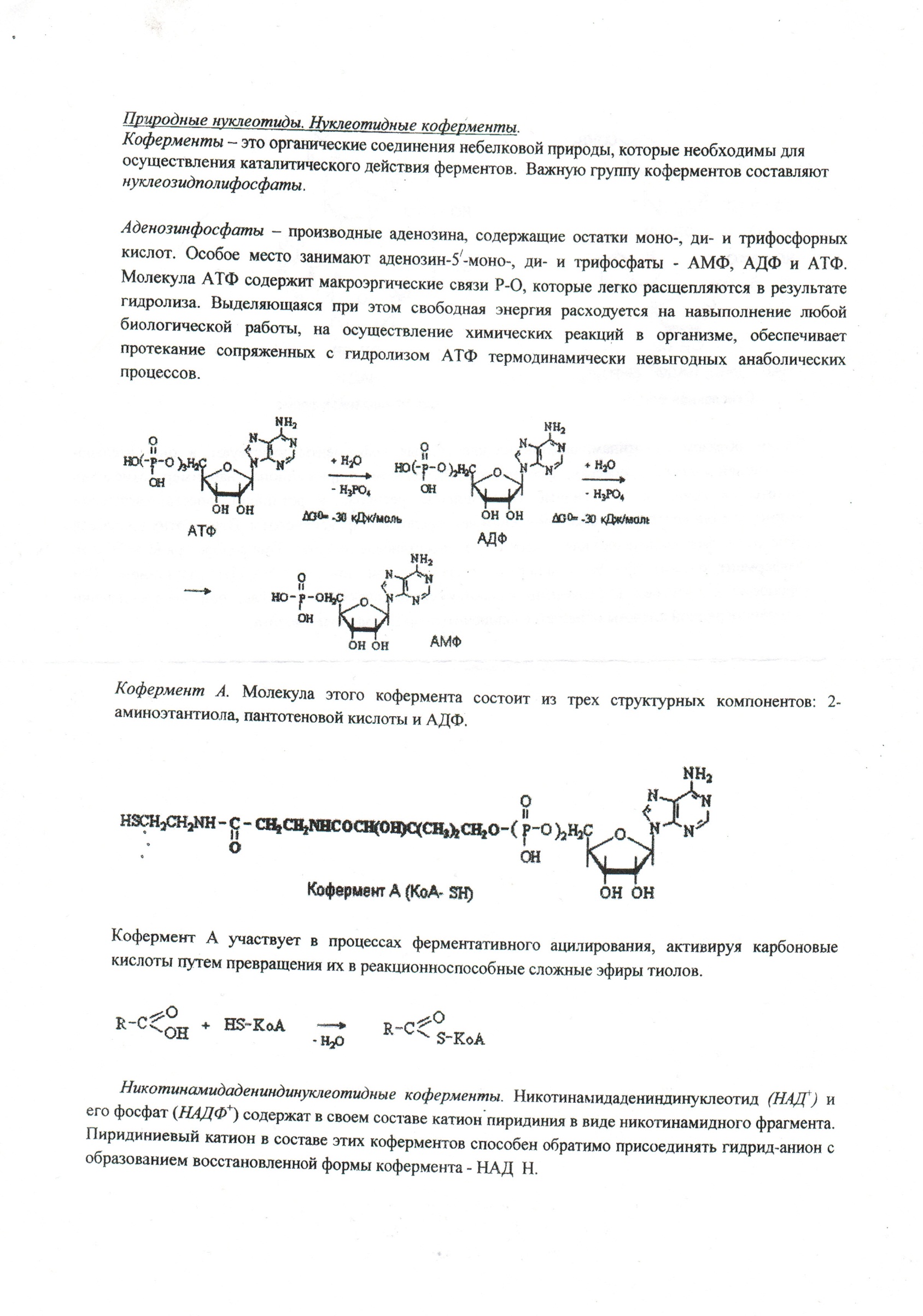
25. Кофермент а – строение и биол. Роль

26. НАД - строение,
биол. Роль![]()

27. Строение и функции ферментов
Ферменты – биол. катализаторы белк. природы, синтез. в организме, во много раз ускор. хим. р-ции, протек. в клетке. Они синтез. в акт. и неакт. формах (проферменты: пепсиноген). Ферменты делят на простые (сост. из альфа-АК: все ферменты пищеварит. сист. (пепсин->белки; амилаза->крахмал; липаза->липиды)) и сложные (сост. из белк. части (апофермент) и небелк. части (кофермент/кофактор))
28. Механизм действия ферментов (Еакт, фермент-субстр. Комплекс)
Для протек. хим. р-ции молекулы имеют опред. кол-во энергии. Ферменты пониж. энергию активации Еакт (доп. кол-во нергии, необх. веществам, чтобы провзаимодействовать). Ферменты не сдвигают равновесие в реакции (они спос. более быстрому достиж. равновесия). Образ. продукта происх. через образование активированного фермент-субстратного комплекса |ES|*, послед. распада с образ. фермента и продуктов р-ции. В образ. комплекса чаще участв. ионные связи.
29. Активный центр фермента: строение, функции
В процесс катализа во взаимод. с субстратом вступ. не вся модель, а опред. часток, кот. назыв. активным центром. У простых ферментов АЦ формир. третичной структурой. У сложных – коферментами (НАД+, ФАД, витамины). В АЦ – субстратный и каталитический участки. На субстр. идет закрепление, а на каталит. – катализ. Поверхность АЦ должна быть комплементарна геометрии субстрата.
30. Образование фермент-субстратного комплекса (ключ-замок)
Она же модель Фишера: для протек. р-ции необходимо точное структ. соответствие между субстратом и АЦ фермента, т.е. каждый фермент подход. к субстрату, как ключ к замку.
31. Образование фермент-субстратного комплекса (рука-перчатка)
Она же модель Кошланда: при взаимод. АЦ фермента «подстраивается» под форму субстрата путем конформационных переходов, кот. начин. и происх. при сближении фермента и субстрата.
32. Свойства ферментов (специфичность, термолабильность, рН-чувствительность)
Субстр. специфичность – спос-ть фермента катализ. превращение только опред. субстрата или же группы сходн. по строению субстратов. Специфичность действия – спос-ть фермента катализ. только опред. тип реакции (гидролаза кат. гидролиз, оксидоредуктаза кат. ОВР). Эти два св-ва обусл. строением АЦ. Термолабильность – это неустойчивость ферментов к действию выс. температур. Температурный оптимум (активность фермента макс.) в районе 35-40 град. цельсия. рН-чувствительность: изм. рН влияет на степень ионизации кисл. и аминогрупп АЦ, что и вызыв. изм. конфигурации АЦ. При рН-оптимуме активность фермента максимальна.
33. Виды специфичности ферментов
Различают два гл. вида специфичности ферментов: субстратную специфичность и специфичность действия. Субстратная специфичность - это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. 3 типа субстратной специфичности: 1) абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата; 2) относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов; 3) стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров. Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
