
- •Первичная структура белковой молекулы. Характеристика пептидной связи (из пред.)
- •Виды вторичной структуры белковой молекулы. Связи, стабилиз. Втор. Структуру.
- •Классификация простых белков. Основные представители.
- •Классификация сложных белков. Основные представители.
- •69. Переваривание нуклеопротеидов в жкт
- •89. Половые гормоны
- •Ферменты
- •25. Кофермент а – строение и биол. Роль
- •27. Строение и функции ферментов
- •28. Механизм действия ферментов (Еакт, фермент-субстр. Комплекс)
- •33. Виды специфичности ферментов
- •34. Активность ферментов. Ингибирование и активация ферментов
- •35. Классификация и номенклатура ферментов
- •Метаболизм. Дыхательная цепь. Ок. Фосфорелирование
- •36. Метаболизм. Осн. Метаболические пути
- •37. Этапы метаболизма. Пути синтеза атф в организме жив. И чел.
- •38. Биологическое окисление. Тканевое дыхание
- •39. Ферменты тканевого дыхания (над, фад, кофермент q, цитохромы)
- •40. Дыхательная цепь. Окислительное фосфорилирование
- •41. Этапы митохондриальной цепи переноса электронов (дыхательной цепи)
- •42. Образование атф путем окислит. Фосфорилирования
- •Нуклеиновые кислоты: виды, строение, биолог. Св-ва
- •Днк: строение, св-ва, биолог. Роль
- •Рнк: виды, строение, биолог. Роль
- •Нуклеотиды, нуклеозиды
- •57. Желчные кислоты: строение, св-ва, биол. Роль в переваривании липидов
- •63. Холестерол. Строение, биологическая роль
- •64. Синтез холестерина
- •Углеводы
- •43. Классификация и биол. Функции углеводов
- •44. Переваривание углеводов в жкт
- •45. Переваривание клетчатки у жвачных животных
- •46. Синтез и распад гликогена в печени
- •47. Анаэробный распад у/в в тканях. Гликолиз. Энергетический эффект
- •48. Гликогенолиз. Энергетический эффект
- •49. Аэробный распад у/в в тканях. Окислительное декарбоксилирование пвк
- •50. Цикл трикарбоновых кислот. Энергетический эффект
- •52. Энергетика полного окисления глюкозы
- •53. Виды брожения у/в. Применение в пищевом производстве
Денатурация белка. Виды денатурации. Денатурир. агенты. Это разруш. всех структур белка, кроме первичной. Она сопровожд. необр. потерей растворимости, вязкости и полной потерей биол. активности. При денатурации остаются АК-ты. Факторы, вызыв. денатурацию: физический (возд. выс. и низких Т, ультраф. и микроволн. излуч., механич. возд., иониз. заряж. частиц), химический (конц. к-ты и щелочи, орг. растворители, соли тяж. Ме, возд. специф. реактивов)
Коллоидные свойства растворов белков. Растворы белков – коллоиды. Облад. св-вами: 1) светорассеивание; 2) вязкость; 3) неспос-ть белк. частиц проникать через полупрониц. мембраны, это св-во лежит в основе разд. и очистки белков методом диализа
Диализ. Это способ разделения и очистки белков с помощью полупроницаемой мембраны; метод разделяет низко- и высоко-молек. соединения через мембрану.
Биологические функции белков. Каталитическая/ферментативная; транспортная; регуляторная/гормональная; резервная; структурная; защитная; рецепторная; сократительная.
Классификация белков. По форме: глобулярные (коллаген) и фибриллярные. По составу: протеины (при их полном гидролизе образ. только АК-ты) и протеиды (при гидролизе образ. АК-ты и дополнительные небелковые компоненты – простетическая группа (углеводы, липиды, витамины))
Классификация простых белков. Основные представители.
альбумины (белки плазмы крови): небольшая масса 60-70 кДн, раств. в воде, нераств. в насыщ. р-рах солей, облад. кисл. св-вами, имеют отриц. заряд при физиолог. рН
глобулины (белки плазмы крови): слабокислые, слабораств. в воде, раств. в р-рах солей, высаливаются
гистоны (глобин гемоглобина): малая масса, осн. хар-р, образ. комплексы с ДНК, содерж. в яд. хроматине
протамины (клупеин, сальмин): малая масса, раств. в воде, осн. хар-р, содерж. в молоках рыб
глутелины (глутелин пшеницы, оризенин риса): нераств. в воде, раств. в щелочах/кислотах, содерж. в семенах злаков, зел. листьях
Проламины (глиадин, гордеин): нераств. в воде, раств. в сл. р-рах спиртов, содерж. много пролина
склеропротеины (коллаген кажи, кератины волос): нераств. фибрил. белки, трудно гидролиз., набух. в воде с образ. студней и гелей
Классификация сложных белков. Основные представители.
нуклеопротеиды (нуклеокапсиды вирусов) – это комплексы белков с РНК и ДНК
гликопротеиды (муцин, хондромукоид) – комплекс белка и углевода
фосфопротеиды (казеин молока) – содержат остатки фосф. к-ты
хромопротеиды (гемоглобин, миоглобин) – содержат пигменты
липопротеиды (образ. мембраны клеток, в сост. нервной ткани) - с липидами
металлопротеиды (ферритин, трансферрин) – в качестве простет. группы ионы Ме (Со, Mg, Cu, Fe)
65. Переваривание простых белков в ЖКТ. Перевар. начин. в желудке; клетки слизистой желудка секрет. пепсиноген, кот. под действием HCl перех. в акт. пепсин (рН=1.5-2.0). Пепсин видоспецифичен, гидролизует пепт. св., образ. аромат. АК – тирозином, триптофаном, фенилаланином, аланином и серином. Продукт гидролиза белка – смесь пептидов – поступ. в 12-типерстную кишку, где нейтрализ. трипсином, химотрипсином, карбоксипептидазой, аминопептидазой, ди- и трипептидазой, выраб. в слиз. кишечника (трипсиноген активируется энтерокиназой до трипсина). Трипсин гидролиз. одну пепт. св. – между Арг и Лиз. Химотрипсин выраб. в виде неакт. химотрипсиногена. Химотрипсин расщепляет пепт. связи, образ. аромат. АК – метионином и лейцином. Карбоксипептидаза, аминопептидаза отщепл. конц. пептидные связи от С- и N-концов пептида. Ди- и трипептидаза расщепл. ди- и три-пептиды до АК. АК всас. в кровь, разнос. ко всем органам и тканям. АК попад. в тонкий отдел кишечника, где наход. бактерии, превр. АК до вредных веществ.
66. Превращение АК в тканях. Окислительное дезаминированиеИсп. для синтеза белков, ферментов, нукл. кислот, пептидных гормонов, пигментов и др. соед. Часть АК окисляется. Есть 3 типа превращений АК: окислительное дезаминирование, трансаминирование, декарбоксилирование. Окисл. дезаминирование АК-т идет путем дегидрирования и катализ. ферментами дегидрогеназами с НАД+/ФМН.Аммиак обезвреживается путем превр. его в печени в мочевину, которая удал. с мочой. Кетокислоты: 1) подверг. окислит. декарбоксил. до ЖК-т, кот. окисл. до СО2 и воды; 2) участв. в синтезе замен. АК-т путем реакции трансаминирования; 3) идут на восст. аминирование; 4) поступают в ЦТК.
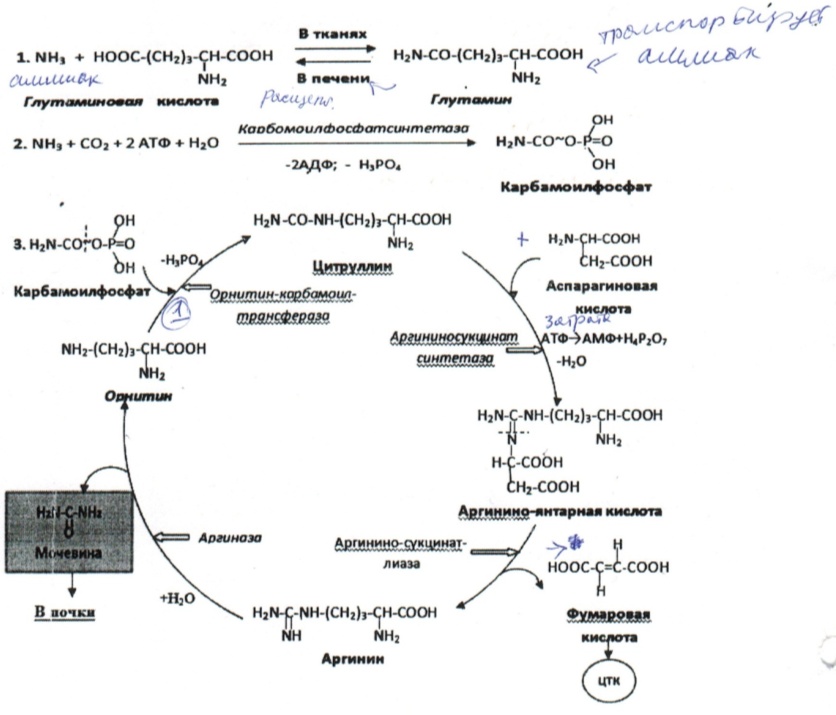
67. Обезвреживание аммиака в тканях. Орнитиновый цикл (биосинтез мочевины)Аммиак выводится в виде аммонийных солей, либо в виде мочевины 95%, кот. синтез. в печени.
68. Основные этапы биосинтеза белка3 стадии: 1) транскрипция; 2) рекогниция; 3) трансляция. Транскрипция (переписывание инф-ции о синтезе белка): мол-ла ДНК раскручивается, открывается ген, на кот. синтезируется матричная РНК. Таким образов, м-РНК перепис. инф-цию с ДНК в виде триплетных кодонов и напр. в рибосому. Переписывание идет по правилу комплементарности (А-Т; Г-Ц). Рекогниция (подготовка АК-т к синтезу): АК-ты активируются АТФ и вступ. во взаимод. с трансп.-РНК. Каждой АК-те соотв. своя т-РНК. Все т-РНК имеют на одном конце цепи один и тот же триплет – ЦЦА. К ОН-группе при 3м угл. атоме рибозы аденозина триплета ЦЦА эфирной связью прикрепл. АК-та, образуется аминоацил. Т-РНК напр. к рибосоме. Трансляция (сборка полипепт. цепи в рибосоме): к рибосоме поступ. инф-я м-РНК и аминоацил т-РНК. Трансляция вкл. 3 фазы: инициация (м-РНК присоед. к рибосоме цчастком, содерж. инициир. кодон (АУГ, ГУГ), к этим кодонам прикрепл. первая аминоацил-т-РНК), элонгация (к кодонам м-РНК, наход. в рибосоме, прикрепл. 3 нуклеотида т-РНК; СООН-гр. АК-ты, связ. с первой т-РНК, взаимодействует со своб. NH2-гр. второй аминоацил-т-РНК с образованием пептидной связи; т-РНК отщепл., уходит из рибосомы), терминация (в м-РНК появл. бессмысл. кодон (УАА, УАГ), терминирующий концовки)
