
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 4.
- •Вопрос 5.
- •Вопрос 6.
- •Вопрос 7.
- •Вопрос 8.
- •Вопрос 9.
- •Вопрос 10.
- •Вопрос 11.
- •Вопрос 12.
- •Вопрос 13.
- •Вопрос 14.
- •Вопрос 15.
- •Вопрос 16.
- •Вопрос 17.
- •Вопрос 18.
- •Вопрос 19.
- •Вопрос 20.
- •Вопрос 21.
- •Вопрос 22.
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25.
- •Вопрос 26.
- •Вопрос 27.
- •Вопрос 28.
- •Вопрос 29.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32.
- •Вопрос 33.
- •Вопрос 34.
- •Вопрос 35.
- •Вопрос 36.
- •Вопрос 37.
- •Вопрос 38.
- •Вопрос 39.
- •Вопрос 40.
- •Вопрос 41.
- •Вопрос 42.
- •Вопрос 43.
- •Вопрос 44.
- •Вопрос 45.
- •Вопрос 46.
- •Вопрос 47.
- •Вопрос 48.
- •Вопрос 49.
- •2. Общая характеристика d-элементов
- •3. Кислотно-основные и окислительно-восстановительные свойства и закономерности их изменения
- •Вопрос 50.
- •Вопрос 51.
- •Вопрос 52.
Вопрос 42.
Химические реакции в растворах электролитов протекают, как правило, с высокими скоростями, и химическое равновесие большинства процессов устанавливается быстро.
Химические свойства раствора электролита складываются изсвойств образующих его ионов. Группа электролитов, содержащаяодин и тот же вид ионов, обладает сходными химическими свойствами. Так, все растворы, содержащие хлорид-ионы, при добавлениик ним раствора нитрата серебра дают белый осадок хлоридасеребраAgCl. Подобные качественные реакции на данный вид ионовшироко используются в аналитической химии при определении состава растворов.
Основным фактором, влияющим на смещение равновесия в растворах электролитов, является изменение концентрации ионов. Поэтому обменные реакции в растворах идут в сторону малорастворимых веществ или слабых электролитов. Это правило легко объяснимо, так как в результате протекания таких процессов один или несколько видов ионов выводятся из сферы взаимодействия, что в соответствии с принципом Ле-Шателье должно привести к более полному протеканию реакции. Малорастворимые вещества могут выводится из раствора или в виде осадка, или в виде газа. Слабыми электролитами могут быть кислоты и основания, вода и комплексы.
Произведение растворимости – величина, количественно характеризующая способность электролита растворяться.
Каждое условно нерастворимое вещество в некоторой степени все же растворяется, образуя при этом насыщенный раствор. Процесс диссоциации: Ag=Ag++Cl- Пр=[ Ag+]+[ Cl-]
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре.
Вопрос 43.
Гидролиз – процесс взаимодействия соли с водой с образованием слабого электролита.
Гидролизу будут подвергаться соли, образованные:
сильным основанием и слабой кислотой.
слабым основанием и сильной кислотой.
слабым основанием и слабой кислотой.
Соли, образованные сильным основанием и слабой кислотой(Na2СO3, Na2S,) гидролизуются по аниону и раствор имеет щелочную реакцию среды:
\Na2CO32-+H2O=NaHCO3+NaOH
Соли, образованные слабым основанием и сильной кислотой(ZnCl2,Al2(SO4)3) гидролизуются по катиону и раствор имеет кислую реакцию среды:
ZnCl2+H2O=ZnOHCl+HCl
Соли, образованные слабым основанием и слабой кислотой ((NH4)2CO3, (NH4)2S) гидролизуются как по катиону, так и по аниону: (NH4)2CO3+2H2O=H2CO3+2NH4OH
Гидролиз возрастает с разбавлением раствора и пи увеличении температуры. Для подавления гидролиза следует ввести в раствор соли соответствующие кислоту или щелочь, являющиеся продуктами гидролиза.
Степень гидролиза показывает, какая часть от общего количества растворенной в воде соли подверглась гидролизу. Степень гидролиза очень часто выражают в процентах:
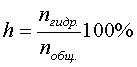 .
.
Константа гидролиза – величина, равная произведению констант всех стадий, из которых складывается процесс гидролиза с учетом стехиометрических коэффициентов. Например:
NH4Cl → NH4+ +
Cl-;
H2O ![]() H+ +
OH-;
K1 = Kw = 10-14;
NH4+ +
OH-
NH4OH;
K2 = 1/K(NH4OH) = 1/1,7·10-5
NH4+ + H2O
NH4OH
+ H+;
Kобщ = K1·K2=5,7·10-10.
H+ +
OH-;
K1 = Kw = 10-14;
NH4+ +
OH-
NH4OH;
K2 = 1/K(NH4OH) = 1/1,7·10-5
NH4+ + H2O
NH4OH
+ H+;
Kобщ = K1·K2=5,7·10-10.
Чем выше величина константы, тем сильнее соль подвергается гидролизу.
Факторы, влияющие на гидролиз
Концентрация соли. Поскольку гидролиз — процесс обратимый, то добавление воды в раствор будет способствовать смещению этой равновесной реакции вправо, т. е. разбавление соли усиливает ее гидролиз.
Температура. Все реакции нейтрализации идут с выделением теплоты. Следовательно, гидролиз — процесс эндотермический:
соль + вода = продукты гидролиза — Q.
Согласно принципу Ле-Шателье повышение температуры для таких процессов способствует смещению равновесия вправо, т. е. усиливает гидролиз соли.
Влияние кислот и оснований. Процессы гидролиза солей сопровождаются выделением ионов Н+ или ОН–. Поэтому добавление кислоты к раствору соли, гидролиз которой проходит по катиону, т. е. с образованием ионов Н+, смещает равновесие обратимого процесса влево, процесс гидролиза подавляется. Добавление к этому же раствору щелочи, наоборот, приводит к смещению равновесия вправо, так как ионы ОН– будут связывать ионы Н+ в молекулы воды, т. е. гидролиз усилится.
