
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 4.
- •Вопрос 5.
- •Вопрос 6.
- •Вопрос 7.
- •Вопрос 8.
- •Вопрос 9.
- •Вопрос 10.
- •Вопрос 11.
- •Вопрос 12.
- •Вопрос 13.
- •Вопрос 14.
- •Вопрос 15.
- •Вопрос 16.
- •Вопрос 17.
- •Вопрос 18.
- •Вопрос 19.
- •Вопрос 20.
- •Вопрос 21.
- •Вопрос 22.
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25.
- •Вопрос 26.
- •Вопрос 27.
- •Вопрос 28.
- •Вопрос 29.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32.
- •Вопрос 33.
- •Вопрос 34.
- •Вопрос 35.
- •Вопрос 36.
- •Вопрос 37.
- •Вопрос 38.
- •Вопрос 39.
- •Вопрос 40.
- •Вопрос 41.
- •Вопрос 42.
- •Вопрос 43.
- •Вопрос 44.
- •Вопрос 45.
- •Вопрос 46.
- •Вопрос 47.
- •Вопрос 48.
- •Вопрос 49.
- •2. Общая характеристика d-элементов
- •3. Кислотно-основные и окислительно-восстановительные свойства и закономерности их изменения
- •Вопрос 50.
- •Вопрос 51.
- •Вопрос 52.
Вопрос 39.
Электролиты – вещества, обладающие ионной проводимостью тока.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов.
Основные положения теории электролитической диссоциации Аррениуса:
В растворах электролитов происходит самопроизвольный распад – диссоциацмя молекул на ионы, в результате чего раствор становится электропроводящим.
осмотическое давление, tп и tк растворов электролитов зависят не только от аналитической концентрации электролита, но и от степени его диссоциации.
для одного и того же растворенного вещества степень диссоциации увеличивается по мере разбавления растворов.
К электролитам относятся твердые вещества с ионной кристаллической решеткой (большинство солей и оснований) или вещества, состоящие из молекул с полярной связью – HCl, H2SO4, NH3.
Коэффициент изотонический i (коэффициент Вант-Гоффа) – число, показывающее во сколько раз общее количество частиц в растворе больше, чем количество молекул электролита (N)
Степень диссоциации электролитов α- отношение числа частиц молекул, распавшихся на ионы, к общему числу молекул растворенного вещества. Дало возможность разделить электролиты на сильные и слабые.
Сильные (α>30%)
Слабые (α=3-5%).
Вопрос 40.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
почти все органические кислоты и вода;
некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 и др.;
некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Кd
Константы электролитической диссоциации слабых электролитов постоянны и практически независимы от концентрации водного раствора.
Константы электролитической диссоциации слабых электролитов при данной температуре и давлении являются постоянными величинами. Однако это не следует понимать в том смысле, что и степень электролитической диссоциации слабых электролитов представляет собой тоже постоянные величины. Степень электролитической диссоциации электролита меняется с изменением концентрации раствора.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролитаот концентрации раствора: Кдисс.=α2С
Вопрос 41.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Для сильных электролитов в большей степени подходит термин кажущаяся степень диссоциации. Его находят, как отношение кажущегося количества диссоциированных частиц к реальному или из формулы определения изотонического коэффициента (называется фактором Вант-Гоффа и показывает истинное поведение вещества в растворе): α = (i – 1)/(n – 1). Здесь i — изотонический коэффициент, а n — количество образовавшихся ионов. Для растворов, молекулы которых полностью распались на ионы, α ≈ 1, а с уменьшением концентрации α все больше стремится к 1.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Отношение
активности (![]() )
к общей концентрации вещества в растворе
называется коэффициентом
активности:
)
к общей концентрации вещества в растворе
называется коэффициентом
активности:
![]()
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
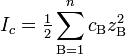 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
