
- •Материалы для подготовки к экзамену по дисциплине «Микробиология, вирусология, иммунология»
- •1. Вопросы для подготовки к экзамену
- •Часть 1. Общая микробиология
- •3 Тип. Ciliophora (ресничные)
- •4 Тип. Microspora (микроспоридии)
- •Царство грибы (fungi, mycota) Отдел 1. Eumycota Отдел 2. Oomycota Отдел 3. Myxomycota Настоящие грибы Оомицеты Слизевики
- •1.Особенности генетического материала прокариот
- •Фагоцитоз: особенности физиологии и функции фагоцитов, стадии фагоцитоза. Методы изучения фагоцитарной активности лимфоцитов.
- •Комплемент, его структура, функции, пути активации, роль в иммунитете. Методы оценки активности системы комплемента.
- •Интерфероны, структура и механизм действия. Способы получения и применения. Лизоцим.
- •Антигены: общие представления, основные свойства, классификация. Антигены бактериальной клетки.
- •Антигены организма человека: антигены групп крови, гистосовместимости, опухольассоциированные и cd-антигены.
- •Иммуноглобулины, структура и функции. Классы иммуноглобулинов, их характеристика.
- •Клеточные популяции иммунной системы. Классификация клеток – участников иммунного ответа по функциональной активности. Клетки апк.
- •Лимфоциты: общая характеристика, классификация. В-лимфоциты, функции, особенности дифференцировки и созревания.
- •Характеристика других клеток иммунной системы. Фагоциты, эозинофилы, тучные клетки, базофилы, дендритные клетки.
- •Опосредованный клетками киллинг. Антителозависимая и антителонезависимая клеточно-опосредованная цитотоксичность.
- •Иммунологическая память. Иммунологическая толерантность.
- •Особенности противовирусного, противогрибкового, противоопухолевого, трансплантационного иммунитета.
- •Реакции гиперчувствительности: общая характеристика и классификация (по Джеллу и Кумбсу). Стадии развития аллергической реакции. Лабораторная диагностика аллергии.
- •Аллергические болезни. Реакции I типа (анафилактические), II типа (гуморальные цитотоксические), III типа (иммунокомплексные) и IV типа (опосредованные т-лимфоцитами).
- •Расстройства иммунной системы: первичные и вторичные иммунодефициты. Аутоиммунные болезни.
- •Иммунодиагностические реакции. Реакции антиген-анитело и реакции с меченными компонентами. Использование в целях идентификации микроорганизмов и диагностики инфекционных заболеваний.
- •Реакции агглютинации. Компоненты, механизм, способы постановки, применение. Реакция непрямой гемагглютинации. Реакция Кумбса. Реакция коагглютинации. Реакция торможения гемагглютинации.
- •Часть 2. Частная микробиология
- •19.1.1. Возбудитель амебиаза (Entamoeba histolytica)
- •19.2. Жгутиконосцы
- •17.3. Возбудители парентеральных вирусных гепатитов d, c, g
- •17.3.1. Вирус гепатита d
- •17.3.2. Вирус гепатита с
- •17.3.3. Вирус гепатита g
1.Особенности генетического материала прокариот
Бактериальная хромосома – 2цеп. кольцевая молекула ДНК, гаплоидный набор генов.
Размер от 3*108 до 2,5*109 Да.
У E. сoli - 5*106 пн
У вирусов – 103пн
У дрожжей – 107пн
У человека – 3*109пн
Ядерные структуры:
- нуклеоид.
Неядерные структуры (транспонируемые генетические элементы):
- плазмиды,
- инсерционные элементы;
- транспозоны;
- эписомы.
Транспонируемые элементы Входят в состав бактериального генома, бактериальной хромосомы и плазмид.
Не являются жизненно необходимыми, так как не кодируют информацию о синтезе ферментов, участвующих в энергетическом метаболизме
Они осуществляют:
· координацию взаимодействий плазмид, умеренных фагов и нуклеоида для обеспечения репродукции;
· регулируют активность генов генома бактериальной клетки;
· могут инактивировать гены, в которые включились («выключение» гена);
· встраиваясь в хромосому, проявляют эффект промотора, включающего или выключающего транскрипцию соответствующих генов.
1. IS – инсерционные элементы (не более 2000пн, несут 1 ген, кодирующий белок транспозазу, самостоятельно не реплицируются). Координируют взаимодействие плазмид, умеренных фагов, транспозонов и генома.
2. Tn – транспозоны. Содержат специф. гены (например, гены устойчивости к лекарствам) и два IS-элемента). Часто содержатся в составе R-плазмид.
3. Эписомы – содержат IS-элементы и транспозоны, способны реплицироваться в автономном или интегрированном в хромосому клетки хозяина состоянии. Собственно говоря, это вирусы (умеренные лизогенные фаги).
4. Плазмиды – двуцеп. ДНК размером от 103 до 106пн, кольцевые или линейные.
Свойства плазмид:
Реплицируются независимо от бакт. хромосомы,
Интегративные плазмиды могут обратимо встраиваться в хромосому и функционировать в виде единого репликона,
Трансмиссивные (коньюгативные) плазмиды способны передаваться из одной клетки в другую (крупные плазмиды, имеющие tra-оперон),
Мобилизуемые плазмиды (мелкие, не несущие tra-оперон) способны передаваться в присутствии трансмиссивных плазмид, используя их аппарат конъюгации.
Реализация генетической информации:
ДНК – носитель наследственной информации, не служит матрицей для синтеза полипептидов.
Передачу записанной в ДНК информации к местам синтеза белка осуществляет матричная или информационная РНК (мРНК). Она состоит из одной цепи и тимин (Т) в РНК заменен урацилом (U).
мРНК синтезируется на одной из цепей ДНК. Этот процесс называется транскрипцией, а перевод нуклеотидной последовательности в последовательность аминокислот – трансляцией.
Изменчивость у прокариот:
Фенотипическая
Генотипическая
а) мутационная
б) рекомбинативная
- трансформация
- трансдукция
- конъюгация
Генотипическая изменчивость:
Генотипом у бактерий называют совокупность индивидуальных генов клетки; ему противопоставляют фенотип – совокупность наблюдаемых признаков. Фенотипическое проявление одного и того же генотипа может быть различным в зависимости от условий среды.
Изменение бактериального генома могут происходить в результате мутаций и рекомбинаций.
Мутации – это изменения в последовательности нуклеотидов ДНК, проявляющиеся наследственно закрепленной утратой или изменением какого-либо признака или группы признаков. В их основе лежат ошибки копирования наследственной информации, возникающие при репликации. Фенотипическим проявлением мутации могут быть: изменение морфологии бактериальной клетки, возникновение потребности в факторах роста (ауксотрофность), появление устойчивости к антибиотикам, изменение чувствительности к температуре, снижение вирулентности (аттенуация).
Мутационная изменчивость:
По протяженности повреждений мутации бывают:
● точечными, когда повреждения ограничиваются одной парой нуклеотидов, (последствия: замена аминокислоты, сдвиг рамки считывания, возникновение бессмысленного кодона),
● протяженными (аберрации).
Мутации разделяют на:
● хромосомные – изменение двух и более участков хромосомы,
● генные – изменение гена или цистрона: модификации оснований, делеции (выпадение нескольких пар нуклеотидов), транспозиции (перемещение группы нуклеотидов в пределах хромосомы), инсерция (разрыв путем вставки посторонней ДНК), дупликация (добавление нуклеотидных пар) и деформации спирали ДНК.
Мутации:
Спонтанные мутации (1 на 106):
● точечные спонтанные мутации возникают из-за ошибок репликации ДНК;
● спонтанные хромосомные аберрации возникают вследствие перемещения подвижных генетических элементов.
2. Индуцированные мутации – в результате направленного действия мутагенов. Мутагены: физические, химические и биологические.
3. Молчащие мутации.
4. Обратная мутация (реверсия).
Вторичная реверсия (супрессорная мутация); интрагенные и экстрагенные супрессорные мутации.
Для точечных мутаций частота реверсий довольно высока, в то время как для аберраций реверсии не характерны.
Новый фенотип проявляется только тогда, когда измененный ген начнет функционировать.
Мутагены:
Физические (высокая температура, УФ, ионизирующее излучение, УЗ колебания).
2. Химические (окислители, алкилирующие соединения, ингибиторы синтеза предшественников н/к и самих н/к).
3. Биологические (живые вакцины, вирусы, токсины бактерий и гельминтов)
Системы репарации у бактерий:
Совокупность ферментов, катализирующих реакции коррекции повреждений ДНК, составляют системы репарации (световые и темновые). Известны три основных механизмов коррекции дефектов ДНК:
● непосредственная реверсия от поврежденной ДНК к исходной структуре;
● эксцизия («выпадение») повреждений с последующим восстановлением исходной структуры;
● активация механизмов, обеспечивающих устойчивость к повреждениям.
Фенотипическая изменчивость у бактерий:
Временные, наследственно не закрепленные изменения называются модификациями (морфологические, биохимические).
Диссоциация микробов:
S-колонии (от англ. smooth – гладкий);
R-колонии (от англ. rough – шероховатый);
М-колонии (от англ. mucoid – слизистый) и
D-колонии (от англ. dwarf – карликовый). Диссоциация протекает обычно в направлении S→R, иногда через образование промежуточных слизистых (М) колоний; обратный (R→S) переход наблюдают значительно реже. Диссоциации сопровождаются изменениями биохимических, морфологических, антигенных и патогенных свойств возбудителей.
Изменение фенотипа следует считать модификацией, если выполняются три основных условия: 1) определенность (связь изменения фенотипа с определенным фактором); 2) общность изменений в популяции; 3) обратимость (восстановление признака после прекращения действия фактора.
Выявление фенотипической изменчивости (модификации). При посеве Proteus mirabilis на питательный агар наблюдают колонии протея, окруженные зоной роения. При пересеве колоний петлей на поверхность питательный агар с 1% сухой желчью зоны роения исчезают, а при пересеве на обычный питательный агар все колонии вновь окружены зоной роения.
Рекомбинативаня изменчивость у бактерий:
Генетическая рекомбинация – взаимодействие между двумя геномами, которое приводит к образованию рекомбинаций ДНК и формированию дочернего генома, сочетающего гены обоих родителей.
Особенности рекомбинаций у бактерий определяются отсутствием истинного полового процесса и мейоза у прокариот и гаплоидным набором генов.
В процессе рекомбинации бактерии условно делятся на клетки-доноры, которые передают генетический материал, и клетки-реципиенты, которые этот материал воспринимают. В клетку-реципиент проникает не вся, а только часть хромосомы клетки-донора, т.е. один или несколько генов. Образуется только один рекомбинант, генотип которого представлен в основном генотипом реципиента с включением фрагментов хромосомы донора.
Мутации и рекомбинации у бактерий. Виды рекомбинаций: гомологичная, сайт-специфическая, незаконная (репликативная).
Мутации – это изменения в последовательности нуклеотидов ДНК, проявляющиеся наследственно закрепленной утратой или изменением какого-либо признака или группы признаков. В их основе лежат ошибки копирования наследственной информации, возникающие при репликации. Фенотипическим проявлением мутации могут быть: изменение морфологии бактериальной клетки, возникновение потребности в факторах роста (ауксотрофность), появление устойчивости к антибиотикам, изменение чувствительности к температуре, снижение вирулентности (аттенуация).
Рекомбинативаня изменчивость у бактерий:
Генетическая рекомбинация – взаимодействие между двумя геномами, которое приводит к образованию рекомбинаций ДНК и формированию дочернего генома, сочетающего гены обоих родителей.
Особенности рекомбинаций у бактерий определяются отсутствием истинного полового процесса и мейоза у прокариот и гаплоидным набором генов.
В процессе рекомбинации бактерии условно делятся на клетки-доноры, которые передают генетический материал, и клетки-реципиенты, которые этот материал воспринимают. В клетку-реципиент проникает не вся, а только часть хромосомы клетки-донора, т.е. один или несколько генов. Образуется только один рекомбинант, генотип которого представлен в основном генотипом реципиента с включением фрагментов хромосомы донора.
Виды рекомбинации:
Гомологичная – обмен между участками ДНК, обладающими высокой степенью гомологии, происходит в процессе разрыва и воссоединения ДНК через образование промежуточного соединения (крестообразной структуры Холидея или полухиазмы).
Процесс находится под контролем генов REC-системы (гены А, В, С и D), продукты экспрессии которых производят расплетание нитей ДНК, их переориентацию с образованием полухиазмы, затем ее разрезание.
Сайт-специфичная – происходит в определенных участках генома и не требует высокой степени гомологиии ДНК. Не зависит от генов REC-системы.
Например:
встраивание плазмиды в хромосому бактерий (между IS элементами хромосомы и плазмиды);
интеграция ДНК фага в хромосому бактерии.
Незаконная (репликативная) – происходит на любом участке ДНК, не зависит от генов REC-системы.
Например, транспозиция подвижных генетических элементов по репликону или между репликонами.
Рекомбинация между геномами бактерий осуществляется 3-мя механизмами: конъюгацией, трансдукцией и трансформацией
Трансформация – передача генетической информации через выделенную из клетки-донора ДНК.
1928г. Ф Гриффит (опыт с вирулентнотью пневмококков)
По происхождению ДНК может быть плазмидной или хромосомной и нести гены, трансформирующие реципиента. Подобным путем среди бактериальных популяций могут распространять гены, кодирующие факторы вирулентности, однако в обмене генетической информацией трансформация играет незначительную роль.
Трансформирующей активностью обладает только двунитчатая высокоспирализованная ДНК.
В клетку-реципиент проникает только одна нить ДНК, другая – в клеточной мембране подвергается деградации с освобождением энергии, необходимой для проникновения в клетку второй нити ДНК.
Интеграция с хромосомой требует наличия гомологичных участков с трансформирующей ДНК.
Процесс трансформации зависит от компетентности клетки-реципиента и состояния трансформирующей донорской ДНК.
Компетентность клеток бактерий (способность воспринимать трансформирующую ДНК) зависит от присутствия в ЦПМ особых белков, обладающих специфическим аффинитетом к ДНК. Компетентность зависит от фазы роста бактериальной культуры, вида бактерий. Может увеличиваться при обработке культуры раствором хлорида кальция при пониженной температуре.
Трансформация служит хорошим инструментом для картирования хромосом, поскольку трансформированные клетки включают различные фрагменты ДНК. Определение частоты одновременного приобретения двух заданных характеристик (чем ближе расположены гены, тем более вероятно, что они оба включатся в один и тот же участок ДНК) дает информацию о взаиморасположении соответствующих генов в хромосоме.
Трансформация является основным методом генной инженерии, используемым при конструировании рекомбинантных штаммов с заданным геномом.
Трансдукция – передача бактериальной ДНК посредством бактериофага.
1952г. Дж. Ледебург и Н. Циндер (опыты с сальмонеллами)
Так как трансдуцируются лишь небольшие фрагменты ДНК, вероятность рекомбинации, затрагивающей какой-то определенный признак, очень мала: она составляет от 10-6 до 10-8.
Общая (неспецифическая) трансдукция – перенос бактериофагом фрагмента любой части бактериальной хромосомы. Феномен неспецифической трансдукции может быть использован для картирования бактериальной хромосомы.
● Специфическая трансдукция – фаговая ДНК интегрирует в бактерию с образованием профага. При исключении ДНК фага из бактериальной хромосомы захватывается прилегающий к месту включения фаговой ДНК фрагмент бактериальной хромосомы. Специфическая трансдукция может служить механизмом переноса вирулентных генов среди бактерий при условии, что эти гены локализованы в непосредственной близости от мест интеграции профага.
● Абортивная трансдукция. При абортивной трансдукции внесенный фрагмент ДНК донора не встраивается в хромосому реципиента, а остается в цитоплазме и там самостоятельно функционирует. Впоследствии он передается одной из дочерних клеток (т.е. наследуется однолинейно) и затем теряется в потомстве.
Конъюгация
Обязательное условие – трансмиссивная плазмида (F, R), обладающая tra-опероном.
Интегративной трансмиссивной плазмидой является F-фактор. Донорские клетки, имеющие встроенный в хромосому F-фактор, называются Hfr-клетками.
Биологическое значение конъюгации хорошо видна на примере распространения резистентности бактерий к антибиотикам. Устойчивость к антибиотикам бактерия может получить в результате мутации, что происходит 1 раз на каждые 106 клеточных делений. Изменившаяся генетическая информация может быстро распространяться среди сходных бактерий посредством конъюгации.
Механизмы передачи генетического материала у бактерий: конъюгация, трансдукция, трансформация.
Рекомбинация между геномами бактерий осуществляется 3-мя механизмами: конъюгацией, трансдукцией и трансформацией
Трансформация – передача генетической информации через выделенную из клетки-донора ДНК.
1928г. Ф Гриффит (опыт с вирулентнотью пневмококков)
По происхождению ДНК может быть плазмидной или хромосомной и нести гены, трансформирующие реципиента. Подобным путем среди бактериальных популяций могут распространять гены, кодирующие факторы вирулентности, однако в обмене генетической информацией трансформация играет незначительную роль.
Трансформирующей активностью обладает только двунитчатая высокоспирализованная ДНК.
В клетку-реципиент проникает только одна нить ДНК, другая – в клеточной мембране подвергается деградации с освобождением энергии, необходимой для проникновения в клетку второй нити ДНК.
Интеграция с хромосомой требует наличия гомологичных участков с трансформирующей ДНК.
Процесс трансформации зависит от компетентности клетки-реципиента и состояния трансформирующей донорской ДНК.
Компетентность клеток бактерий (способность воспринимать трансформирующую ДНК) зависит от присутствия в ЦПМ особых белков, обладающих специфическим аффинитетом к ДНК. Компетентность зависит от фазы роста бактериальной культуры, вида бактерий. Может увеличиваться при обработке культуры раствором хлорида кальция при пониженной температуре.
Трансформация служит хорошим инструментом для картирования хромосом, поскольку трансформированные клетки включают различные фрагменты ДНК. Определение частоты одновременного приобретения двух заданных характеристик (чем ближе расположены гены, тем более вероятно, что они оба включатся в один и тот же участок ДНК) дает информацию о взаиморасположении соответствующих генов в хромосоме.
Трансформация является основным методом генной инженерии, используемым при конструировании рекомбинантных штаммов с заданным геномом.
Трансдукция – передача бактериальной ДНК посредством бактериофага.
1952г. Дж. Ледебург и Н. Циндер (опыты с сальмонеллами)
Так как трансдуцируются лишь небольшие фрагменты ДНК, вероятность рекомбинации, затрагивающей какой-то определенный признак, очень мала: она составляет от 10-6 до 10-8.
Общая (неспецифическая) трансдукция – перенос бактериофагом фрагмента любой части бактериальной хромосомы. Феномен неспецифической трансдукции может быть использован для картирования бактериальной хромосомы.
● Специфическая трансдукция – фаговая ДНК интегрирует в бактерию с образованием профага. При исключении ДНК фага из бактериальной хромосомы захватывается прилегающий к месту включения фаговой ДНК фрагмент бактериальной хромосомы. Специфическая трансдукция может служить механизмом переноса вирулентных генов среди бактерий при условии, что эти гены локализованы в непосредственной близости от мест интеграции профага.
● Абортивная трансдукция. При абортивной трансдукции внесенный фрагмент ДНК донора не встраивается в хромосому реципиента, а остается в цитоплазме и там самостоятельно функционирует. Впоследствии он передается одной из дочерних клеток (т.е. наследуется однолинейно) и затем теряется в потомстве.
Конъюгация
Обязательное условие – трансмиссивная плазмида (F, R), обладающая tra-опероном.
Интегративной трансмиссивной плазмидой является F-фактор. Донорские клетки, имеющие встроенный в хромосому F-фактор, называются Hfr-клетками.
Биологическое значение конъюгации хорошо видна на примере распространения резистентности бактерий к антибиотикам. Устойчивость к антибиотикам бактерия может получить в результате мутации, что происходит 1 раз на каждые 106 клеточных делений. Изменившаяся генетическая информация может быстро распространяться среди сходных бактерий посредством конъюгации.
Плазмиды бактерий, их функции и свойства. Использование плазмид в генной инженерии. Медицинская биотехнология, ее задачи и достижения.
Плазмиды представляют собой двухцепочечные молекулы ДНК размером от 103 до 106 н.п. Они могут быть кольцевой формой и линейными. Плазмиды кодируют не основные для жизнедеятельности бактериальной клетки функции, но придающие бактерии преимущества при попадании в неблагоприятные условия существования.
Среди фенотипических признаков, сообщаемых бактериальной клетке плазмидами, можно выделить следующие:
• устойчивость к антибиотикам;
• продукцию факторов патогенности;
• способность к синтезу антибиотических веществ;
• образование колицинов;
• расщепление сложных органических веществ;
• образование ферментов рестрикции и модификации. Репликация плазмид происходит независимо от хромосомы с
участием того же набора ферментов, который осуществляет репликацию бактериальной хромосомы (см. раздел 3.1.7 и рис. 3.5).
Некоторые плазмиды находятся под строгим контролем. Это означает, что их репликация сопряжена с репликацией хромосомы так, что в каждой бактериальной клетке присутствует одна или, по крайней мере, несколько копий плазмид.
Число копий плазмид, находящихся под слабым контролем, может достигать от 10 до 200 на бактериальную клетку.
Для характеристики плазмидных репликонов их принято разбивать на группы совместимости. Несовместимость плазмид связана с неспособностью двух плазмид стабильно сохраняться в одной и той же бактериальной клетке. Несовместимость свойственна тем плазмидам, которые обладают высоким сходством репликонов, поддержание которых в клетке регулируется одним и тем же механизмом.
Плазмиды, которые могут обратимо встраиваться в бактериальную хромосому и функционировать в виде единого репликона, называются интегративными или эписомами.
Плазмиды, способные передаваться из одной клетки в другую, иногда даже принадлежащую иной таксономической единице, называются трансмиссивными (конъюгативными) Трансмиссивность присуща лишь крупным плазмидам, имеющим tra-оперон, в который объединены гены, ответственные за перенос плазмиды. Эти гены кодируют половые пили, которые образуют мостик с клеткой, не содержащей трансмиссивную плазмиду, по которой плазмидная ДНК передается в новую клетку. Этот процесс называется конъюгацией (подробно он будет рассмотрен в разделе 5.4.1). Бактерии, несущие трансмиссивные плазмиды, чувствительны к «мужским» нитевидным бактериофагам.
Мелкие плазмиды, не несущие tra-гены, не могут передаваться сами по себе, но способны к передаче в присутствии трансмиссивных плазмид, используя их аппарат конъюгации. Такие плазмиды называются мобилизуемыми, а сам процесс - мобилизацией нетрансмиссивной плазмиды.
Особое значение в медицинской микробиологии имеют плазмиды, обеспечивающие устойчивость бактерий к антибиотикам, которые получили название R-плазмид (от англ. resistance - противодействие), и плазмиды, обеспечивающие продукцию факторов патогенности, способствующих развитию инфекционного процесса в макроорганизме. R-плазмиды содержат гены, детерминирующие синтез ферментов, разрушающих антибактериальные препараты (например, антибиотики). В результате наличия такой плазмиды бактериальная клетка становится устойчивой (резистентной) к действию целой группы лекарственных веществ, а иногда и к нескольким препаратам. Многие R-плазмиды являются трансмиссивными, распространяясь в популяции бактерий, делая ее недоступной к воздействию антибактериальных препаратов. Бактериальные штаммы, несущие R-плазмиды, очень часто являются этиологическими агентами внутрибольничных инфекций.
Плазмиды, детерминирующие синтез факторов патогенности, в настоящее время обнаружены у многих бактерий, являющихся возбудителями инфекционных заболеваний человека. Патогенность возбудителей шигеллезов, иерсиниозов, чумы, сибирской язвы, иксодового бореллиоза, кишечных эшерихиозов связана с наличием у них и функционированием плазмид патогенности.
Некоторые бактериальные клетки содержат плазмиды, детерминирующие синтез бактерицидных по отношению к другим бактериям веществ. Например, некоторые Е. coli владеют Col-плазмидой, определяющей синтез колицинов, обладающих микробоцидной активностью по отношению к колиформным бактериям. Бактериальные клетки, несущие такие плазмиды, обладают преимуществами при заселении экологических ниш.
Плазмиды используются в практической деятельности человека, в частности в генной инженерии при конструировании специальных рекомбинантных бактериальных штаммов, вырабатывающих в больших количествах биологически активные вещества (см. главу 6).
Биотехнология представляет собой область знаний, которая возникла и оформилась на стыке микробиологии, молекулярной биологии, генетической инженерии, химической технологии и ряда других наук. Рождение биотехнологии обусловлено потребностями общества в новых, более дешевых продуктах для народного хозяйства, в том числе медицины и ветеринарии, а также в принципиально новых технологиях. Биотехнология — это получение продуктов из биологических объектов или с применением биологических объектов. В качестве биологических объектов могут быть использованы организмы животных и человека (например, получение иммуноглобулинов из сывороток вакцинированных лошадей или людей; получение препаратов крови доноров), отдельные органы (получение гормона инсулина из поджелудочных желез крупного рогатого скота и свиней) или культуры тканей (получение лекарственных препаратов). Однако в качестве биологических объектов чаще всего используют одноклеточные микроорганизмы, а также животные и растительные клетки.
Клетки животных и растений, микробные клетки в процессе жизнедеятельности (ассимиляции и диссимиляции) образуют новые продукты и выделяют метаболиты, обладающие разнообразными физико-химическими свойствами и биологическим действием.
Биотехнология использует эту продукцию клеток как сырье, которое в результате технологической обработки превращается в конечный продукт. С помощью биотехнологии получают множество продуктов, используемых в различных отраслях:
• медицине (антибиотики, витамины, ферменты, аминокислоты, гормоны, вакцины, антитела, компоненты крови, диагностические препараты, иммуномодуляторы, алкалоиды, пищевые белки, нуклеиновые кислоты, нуклеозиды, нуклеотиды, липиды, антиметаболиты, антиоксиданты, противоглистные и противоопухолевые препараты);
• ветеринарии и сельском хозяйстве (кормовой белок: кормовые антибиотики, витамины, гормоны, вакцины, биологические средства защиты растений, инсектициды);
• пищевой промышленности (аминокислоты, органические кислоты, пищевые белки, ферменты, липиды, сахара, спирты, дрожжи);
• химической промышленности (ацетон, этилен, бутанол);
• энергетике (биогаз, этанол).
Следовательно, биотехнология направлена на создание диагностических, профилактических и лечебных медицинских и ветеринарных препаратов, на решение продовольственных вопросов (повышение урожайности, продуктивности животноводства, улучшение качества пищевых продуктов — молочных, кондитерских, хлебобулочных, мясных, рыбных); на обеспечение многих технологических процессов в легкой, химической и других отраслях промышленности. Необходимо отметить также все возрастающую роль биотехнологии в экологии, так как очистка сточных вод, переработка отходов и побочных продуктов, их деградация (фенол, нефтепродукты и другие вредные для окружающей среды вещества) осуществляются с помощью микроорганизмов.
В настоящее время в биотехнологии выделяют медико-фармацевтическое, продовольственное, сельскохозяйственное и экологическое направления. В соответствии с этим биотехнологию можно разделить на медицинскую, сельскохозяйственную, промышленную и экологическую. Медицинская в свою очередь подразделяется на фармацевтическую и иммунобиологическую, сельскохозяйственная — на ветеринарную и биотехнологию растений, а промышленная — на соответствующие отраслевые направления (пищевая, легкая промышленность, энергетика и т. д.).
Биотехнологию также подразделяют на традиционную (старую) и новую. Последнюю связывают с генетической инженерией. Общепризнанное определение предмета «биотехнология» отсутствует и даже ведется дискуссия о том, наука это или производство.
Молекулярно-генетические методы, используемые в диагностике инфекционных болезней (полимеразная цепная реакция, метод молекулярной гибридизации, рестрикционный анализ).
Полимеразная цепная реакция. Этот метод относится к самым современным методам исследования, без которого не мыслима ни одна крупная микробиологическая лаборатория нашего времени.
А. ПЦР можно проводить для достижения трех целей.
1. Для обнаружения в патологическом материале конкретного вида микроорганизма без выделения чистой культуры.
2. Для идентификации выделенных чистых культур микроорганизмов.
3. Для генотипирования микроорганизмов, т.е. определения генетических вариантов одного вида.
Б. Принцип осуществления ПЦР заключается в увеличении (амплификации) количества искомого гена при положительной или (отсутствие такого увеличения) при отрицательной реакции.
Рис. 14.2-1. Принцип положительной ПЦР: экстракция ДНК и, если в ней содержится искомый ген, ее количество в процессе реакции резко увеличивается, что выявляется с помощью электрофореза
1. Сначала из патологического материала или культуры микроорганизмов выделяется ДНК.
2. Затем путем нагрева в щелочной среде ДНК расплетается на две отдельные нити.
3. После этого в реакционную смесь добавляют праймеры (участки ДНК, комплементарные 3’-концам искомого гена).
4. Реакционную смесь охлаждают.
5. Если в исследуемой ДНК имеется искомый ген, то праймеры создают фрагменты двухцепочечной ДНК, связываясь с комплементарными участками «своего» гена.
6. Затем в реакционную смесь добавляют нуклеотиды и ДНК-полимеразу.
7. Если в реакционной смеси наличествуют двухцепочечные фрагменты ДНК, то нуклеотиды при-соединяются к 3’-концам праймеров, полностью достраивая соответствующий ген на всем его протяжении. А так как синтез начинался на каждой нити ДНК отдельно, то в результате получается две молекулы двухцепочечного ДНК. Другими словами, количество ДНК увеличивается в два раза.
8. Повторение циклов (от 30 до 80 раз) приводит к накоплению (амплификации) искомого гена.
9. На завершающем этапе определяют количество ДНК в реакционной смеси с помощью электрофореза. При положительной реакции оно резко возрастает, в случае отрицательного результата – не из-меняется. Полимеразная цепная реакция – сложная процедура, требующая квалифицированного персонала, комплекса оборудования и специальных расходных материалов. Для проведения реакции оборудуется специальное помещение, которое часто так и называется: лаборатория ПЦР.
Метод молекулярной гибридизации Этот метод используется для выявления степени сходства различных ДНК (при идентификации мик-роорганизмов проводят сравнение ДНК выделенного штамма с ДНК эталонного штамма).
А. Исследуемую ДНК нагревают в щелочной среде для расплетения ее на две отдельные нити.
Б. Одну из них закрепляют на специальном фильтре.
В. Этот фильтр помещают в раствор, содержащий радиоактивный зонд (одноцепочечную молекулу ДНК эталонного штамма, меченную радиоактивным изотопом).
Г. Затем температуру реакционной смеси понижают, чтобы создать условия для восстановления двухцепочечной структуры ДНК.
Д. В случае, если исследуемая ДНК и ДНК эталонного штамма относятся к одному виду – в реакцион-ной смеси формируется двухцепочечная ДНК. При отрицательной реакции двухцепочечная ДНК не формируется (для оценки реакции используется биохимическая методика). На практике все связи двух цепочек полностью не восстанавливаются из-за высокого уровня генетической изменчивости микро-организмов, поэтому реакцию оценивают по степени гомологии – проценту восстановленных связей между двумя цепочками ДНК.
Этот метод основан на способности ферментов рестрикции специфически расщеплять ДНК в определённых сайтах.
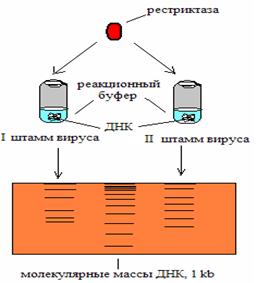
Рис. 7. Схема рестрикционного анализа
Если происходит изменение в сайте узнавания (мутация, рекомбинация, метилирование ДНК и т.д.) рестриктаза теряет способность выполнять свою функцию. Основная идея заключается в следующем: различные последовательности ДНК приводят к расщеплению ДНК ферментами рестрикции в разных местах. Полученные с помощью рестриктаз фрагменты ДНК служат маркерами различных процессов, происходящих внутри клетки исследуемого организма.
Специфические биологические особенности и морфология вирусов. Структура и химический состав вирусов и бактериофагов.
Специфические особенности вирусов:
-Ультрамикроскопические размеры (от 15-30 до 200-500нм)
-Неклеточное строение
-Отсутствие собственного метаболизма
-Содержание только одного типа нуклеиновой кислоты
-Размножение путем репродукции в живых клетках
-Облигатный внутриклеточный паразитизм на генетическом уровне
-Культивирование только в живых клетках
Морфология и строение вирусных частиц:
Формы вирусов:
покоящиеся репродуцирующиеся
(внеклеточные, (внутриклеточные)
вирионы)
-Морфологические типы вирионов
-Сферические (вирусы растений и животных)
-Палочковидные (вирусы растений)
-Нитевидные (вирусы растений)
-Кубические (вирусы животных)
-Булавовидные (вирусы бактерий)
Строение вирусной частицы (вириона):
Вирион:
-Нуклеиновая кислота: -ДНК(1цеп. 2цеп.); -РНК(1 цеп. 2 цеп)
-Капсид
-Суперкапсид
Типы вирионов:
-Простые (безоболочечные, состоят из нуклеиновой кислоты и капсида).
-Сложные (оболочечные, состоят из нуклеокапсида и суперкапсида)
А) Нуклеиновые кислоты вирусов
Геном вирионов представлен только одним типом нуклеиновой кислоты (ДНК или РНК).
Геномные н/к могут быть 1 и 2-цепочечными, линейными и кольцевыми, цельными и фрагментированными на 2-3 …8-12 сегментов (у моновирусов в одном вирионе, у ковирусов – распределены между несколькими вирионами).
Среди РНК-вирусов с 1-цепочечной линейной н/к различают вирусы с позитивным и негативным геномом:
У вирусов с позитивным геномом («плюс-нитевых) РНК обладает информационной функцией, т.е. служит матрицей одновременно для синтеза вирусных н/к и вирусных белков. Механизм реализации генетической информации:
РНК - белок
У вирусов с негативным геномом («минус-нитевых») РНК не обладает информационной функцией. Синтез иРНК у них происходит на матрице минус-РНК с помощью вирусспецифического фермента транскриптазы. Механизм реализации генетической информации: РНК – иРНК - белок
Особыми свойствами обладает геномная РНК ретровирусов (2-цепочечная РНК), имеющих в своем составе обратную транскриптазу (РНК-зависимую ДНК-полимеразу).
С ее помощью на матрице вирусной РНК синтезируется ДНК, а уже затем с этой ДНК информация копируется на иРНК.
Ретровирусы относят к «плюс-нитевым».
Механизм реализации генетической информации:
РНК – ДНК – иРНК - белок
Геном вирусов гаплоидный (частично диплоидны ДНК-вирусы с повторами нуклеотидных последовательностей, полностью диплоидны ретровирусы).
Б) Капсид
Белковая оболочка вириона. Функции: защитная, обусловливает избирательное прикрепление к клеткам хозяина.
Капсидные белки образуют субъединицы или капсомеры (из 2,3,5,6 белковых субъединиц). Количество капсомеров в капсиде от 3-6 десятков до многих сотен.
По характеру расположения капсомеров вирусы делят на три группы: со спиральным (палочковидные и нитевидные вирусы), кубическим (сферические и кубические) и смешанным (бактериофаги) типом симметрии.
Капсиды, прочно соединенные с геномом вирусов, называют нуклеокапсидами.
В) Суперкапсид
Дополнительная оболочка сложных (оболочечных) вирусов. Состоит из углеводов (до 10%), липидов (15-35%) и белков. Углеводы повышают устойчивость белков к протеазам и поддерживают их конформацию. Липиды (фосфолипиды и холестерин) стабилизируют структуру вириона. Суперкапсидные гликопротеиды образуют поверхностные шипы (белки слияния и прикрепления) осуществляют хемосорбцию на клетках-мишенях.
Суперкапсид чаще имеет клеточной происхождение
Г) Особенности строения бактериофагов
Впервые выделены и описаны Ф. д`Эррелем (Канада) в 1917г.
Содержат как ДНК, так и РНК. По характеру взаимодействия с бактериями бывают вирулентными (вызывают лизис бактериальных клеток) и умеренными (интегрируют в бактериальную ДНК).
Очень устойчивы в окружающей среде (t0 до 750С), быстро разрушаются под действием желудочного сока, УФ излучения.
Типо- и видоспецифичны.
Вироиды
Впервые описаны в 1971г. Т.О. Динером (США).
Представляют собой 1-цепочечные кольцевые или линейные молекулы РНК (240-400 нуклеотидов) без капсидов. Их размеры около 15нм.
Вызывают заболевания растений (веретеновидностей клубней картофеля), человека (куру), животных (скрейпи у овец).


Принципы классификации и теории происхождения вирусов. История открытия и специфичность вирусов
1 этап – описательный
1892г. Д.И.Ивановский – установил, что мозаичная болезнь табака вызывается фильтрующимися через бактериальные фильтры инфекционным агентом
1899г. его исследование повторил голландец М.Бейеринк
898г.Ф.Леффлер и П.Фрош доказали вирусную природу возбудителей ящура
1898-1906гг. описание включений вирусов в клетках эпителия больных оспой людей и в нейронах мозга погибших о бешенства животных
1901г. доказана вирусная природа тропической желтой лихорадки и полиомиелита человека, лейкоза кур
1917г. открытие Ф. д,Эррелем бактериофагов
1933г. доказана вирусная природа гриппа
1935г. У.Стэнли получил в чистом виде кристаллы вируса табачной мозаики.
1940г. Э.Гудпасчур предложил для культивирования вирусов куриные эмбрионы
1949г. Дж.Эндерс, Ф.Роббинс, Т.Уэллер – для культивирования предложили однослойные культуры клеток
1953-1957гг. получены в чистой культуре аденовирусы, коксакивирусы, вирусы парагриппа, вирус полиомы и др.
2 этап – «молекулярный»
1960-е гг. – изучение тонкой структуры и репродукции вирусов с помощью электронного микроскопа
1970г. Х.М.Темин и Д.Балтимор выделили из вирусов обратную транскриптазу (начало становления генной инженерии)
70-80-е гг. – описание вирусов-возбудителей геморрагических лихорадок, гепатитов, ВИЧ 3 этап – «генетический»
1972г. открытие вироидов Т.О.Дайнером
1982г. открытие прионов С.Прузинером
90-е гг. бурное развитие генетической инженерии
Классификация вирусов
Первые попытки – 40-е года – по тропизму к определенным тканям.
1953г. – первый определитель вирусов (по эпидемиологии).
1966г. современные подходы, незавершенная классификация (МКТВ).
Основной критерий классификации - тип н/к.
Поэтому в империи Acaryotae (Vira) выделяют 2 царства (группы): РНК-вирусы и ДНК-вирусы. В каждой группе выделяют: семейства (-viridae) подсемейства (-virinae), роды и виды (-virus).
Дополнительные критерии классификации:
Структура н/к (1 и 2цепочечные, полные-недостроенные, цельные-фрагментированные)
Конфигурация н/к (линейные-кольцевые)
Геномная функция («плюс-минус» нитевые)
Наличие суперкапсида
Размер и морфология вириона, тип симметрии, число капсомеров
Особенности репродукции
Феномены генетических взаимодействий
Антигенные свойства
Круг восприимчивых хозяев
Способ передачи
Органно-тканевый тропизм
Криптограммы R/1 : 4/20 : v/v : V / Si
Тип н/к (R – РНК, D - ДНК), через / - число цепочек;
2. Молекулярная масса н/к (в миллионах дальтон). Если РНК фрагментарна, через / указывают % содержание ее в конкретном вирионе;
3. Внешние очертания вириона, через / - очертания нуклеокапсида (s–сферические, e–продолговатые, v–продолговатые с закругленными концами, x-фаги).
4.Хозяин / переносчик (A-актиномицеты, B-бактерии, F-грибы, I-беспозвоночные, V-позвоночные; Ac-клещи, Di-мухи и комары, Ap-тля, Si-блохи, Ve-неизвестны, O-без переносчика)
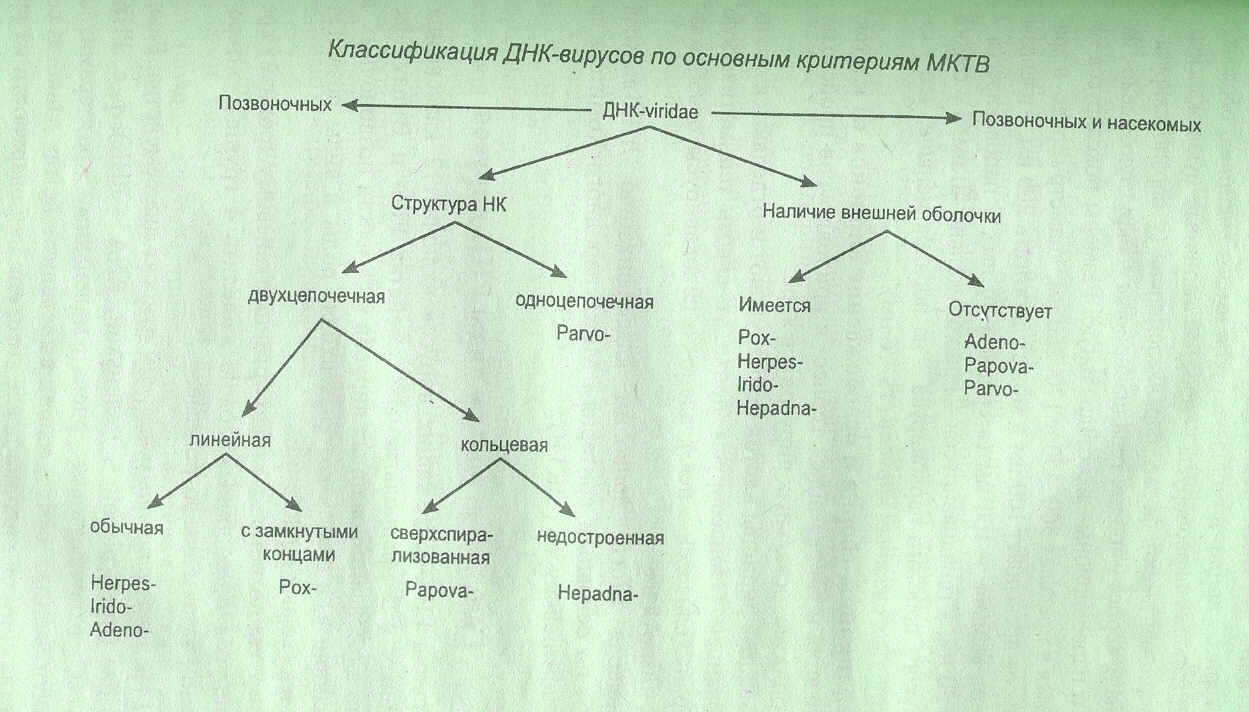
ДНК-вирусы (7 семейств)
Герпесвирусы (herpes – ползучие, греч.) – дерматотропные вирусы человека
Аденовирусы (adenos – железа, греч.) – поражают ВДП и кишечник птиц и млекопитающих
Паповавирусы – вирусы папилломы, полиомы и вакуолизирующие клетки вирус SV-40
Гепаднавирусы – вирусы гепатита В (воспаление печени)
Поксвирусы (pox – пузырек, англ.) – дерматотропные (вирусы оспы человека и животных)
Иридовирусы (iridos – радуга, греч.) – вирусы насекомых, лягушек, рыб, африканской чумы свиней.
7. Парвовирусы (parvus – крошечный, лат.) – вирусы животных, птиц и насекомых.
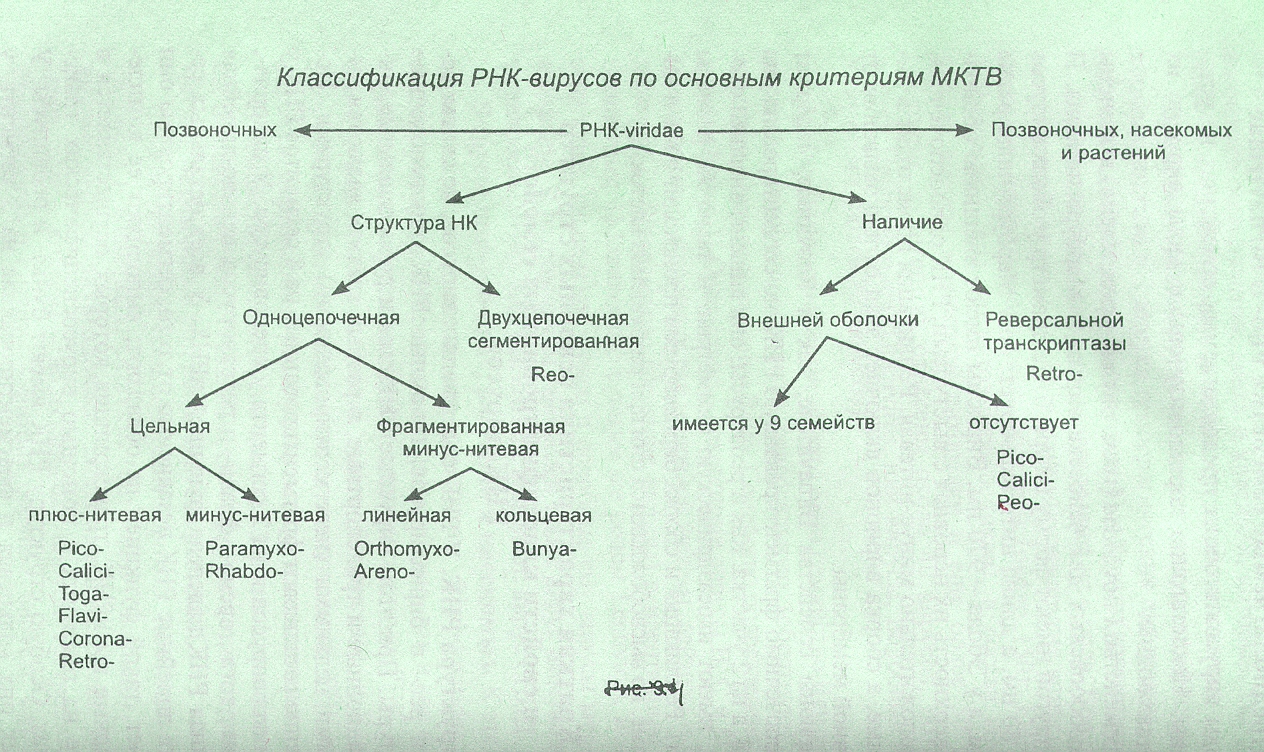
РНК-вирусы (12 классифицированных семейств и 2 предполагаемых, делят на группы)
1. Энтеротропные вирусы (2 семейства): пикорнавирусы (энтеровирусы – полиомиелит, риновирусы - риниты, кардиовирусы - миокардиты, афтовирусы - ящур) и калицивирусы (гастроэнтериты
2. Пневмотропные (3 семейства): ортомиксовирусы (грипп А, В и С), парамиксовирусы (парагрипп, корь, паратит), коронавирусы (ОРЗ).
3. Вазотропные (4 семейства): тогавирусы (энцефалит лошадей), флавивирусы (клещевой энцефалит, краснуха), ареновирусы (геморрагическая лихорадка), буньявирусы (москитная лихорадка).
4. Лимфотропные (1 семейство ретровирусы, 3 подсемейства): онковирусы (лейкоз, лимфосаркома), спурмавирусы (пенящиеся), лентивирусы (медленных инфекций).
Сборные семейства РНК-вирусов
Рабдовирусы – вирус бешенства, в. везикулярного стоматита, в. растений.
Реовирусы: орбивирусы (лихорадка человека), ротавирусы (гастроэнтериты), фитореовирусы и фидживирусы (растений), циповирусы (насекомых).
Предполагаемые вирусы
Филовирусы (в. Марбурга и в. Эбола)
Бирнавирусы
Онкогенные вирусы
ДНК вирусов интегрирует в ДНК хромосом и реплицируется только вместе с ДНК клетки. Клеточная ДНК репрессирует часть вирусного генома, отвечающую за синтез вирусных белков (за исключением «ранних» белков, которые начинают активно синтезироваться клеткой). «Ранние» белки обеспечивают репликацию вирусного генома
Синтез ранних белков - репликация ДНК вируса - репликация ДНК клетки – преждевременное деление клетки- образование опухоли - синтез ранних белков (порочный круг).
Стадии репродукции вирусов. Типы взаимодействия вируса с клеткой
О репродукции вирусов в культуре клеток судят по:
- цитопатогенному действию (ЦПД) или цитопатическому эффекту,
образованию внутриклеточных включений (телец Гварниери, Бабеша-Негри),
образованию бляшек (негативных колоний),
реакциям гемадсорбции и гемагглютинации,
«цветной» реакции.
Фундаментальное отличие вирусов от других инфекционных агентов состоит в механизмах их репродукции: вирусы не способны к самостоятельному размножению. Репликация генетического материала вирусов (ДНК или РНК), а также экспрессия вирусных генов (вирусный ген -» вирусный белок) осуществляются при помощи механизмов репликации, транскрипции, сплайсинга и трансляции инфицированной клетки-хозяина. Циклы репродукции вирусов в инфицированной клетке зависят от типа вирусной нуклеиновой кислоты.
Репродукция +РНК-вирусов
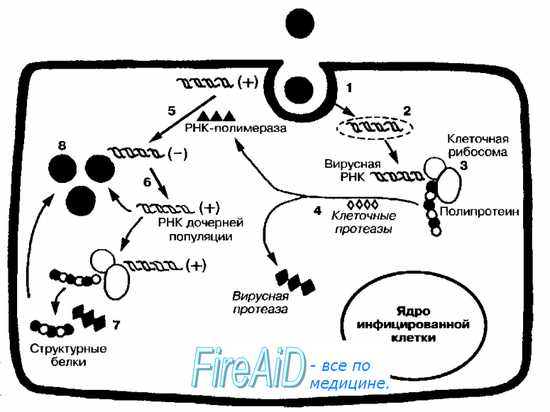
Рис. 5-1. Репродуктивный цикл +РНК-содержащих вирусов. После адсорбции вирус проникает в клетку путём виропексиса (1). Вирусная +РНК высвобождается в цитоплазме (2). Поскольку молекулярная симметрия вирусной +РНК аналогична мРНК, то +РНК может непосредственно распознаваться и транслироваться рибосомами (3). Образуется гигантская полипротеиновая молекула. Клеточные протеазы «нарезают» образующийся вирусный полипротеин (4) с образованием РНК-зависимой РНК-полимеразы, вирусной протеазы, ингибиторов синтеза клеточных РНК и различных структурных белков. РНК-полимераза катализирует образование -РНК на матрице родительской +РНК (5). Затем уже на матрице -РНК происходит многократный синтез молекул +РНК (6), участвующих в синтезе вирусных белков (7) либо входящих в состав генома дочерних популяций вирусов (8).
+РНК-вирусы (например, пикорна- и тогавирусы) проникают в чувствительную клетку путём виропексиса. Репродуктивный цикл начинается после высвобождения вирусного генома в цитоплазме
Пикорнавирусы размножаются подобно большинству +РНК-содержащих вирусов. Среди них наиболее хорошо изучен полиовирус (возбудитель полиомиелита), имеющий небольшие размеры, голый капсид и однонитевую молекулу +РНК. Адсорбционные возможности полиовиру-са ограничены клетками приматов и человека, имеющих специфические рецепторы. Репликация +РНК полностью происходит в цитоплазме клетки. Репродуктивный цикл подразделяют на раннюю и позднюю стадии.
Ранняя стадия репродукции включает процессы, происходящие после проникновения вируса в клетку до образования большого количества копий +РНК в процессе репликации. Поздняя стадия репродукции включает синтез белков капсида. Образованные в репликативном синтезе молекулы +РНК функционируют как мРНК, транслируясь в один гигантский полипептид, нарезаемый протеазами на капсидные белки. После самосборки капсидов формируется зрелая дочерняя популяция. Поскольку пикорнавирусы лишены суперкапсида, то высвобождение популяции сопровождается массивным повреждением клеточной мембраны с последующим лизисом инфицированной клетки.
Известны следующие типы взаимодействий «вирус-клетка»: продуктивный (образуется дочерняя популяция), интегративный (вирогения), абортивный (дочерняя популяция не образуется) и интерференция вирусов (инфицирование чувствительной клетки разными вирусами).
Продуктивное взаимодействие «вирус-клетка» чаще носит литический характер, то есть заканчивается гибелью и лизисом инфицированной клетки, что происходит после полной сборки дочерней популяции. Гибель клетки вызывают следующие факторы: раннее подавление синтеза клеточных белков, накопление токсических и повреждающих клетку вирусных компонентов, повреждение лизосом и высвобождение их ферментов в цитоплазму.
Интегративное взаимодействие, или вирогения, не приводит к гибели клетки. Нуклеиновая кислота вируса встраивается в геном клетки-хозяина и в последующем функционирует как его составная часть. Наиболее яркие примеры подобного взаимодействия — лизогения бактерий и вирусная трансформация клеток.
Абортивное взаимодействие не приводит к появлению дочерней популяции и происходит при взаимодействии вируса с покоящейся клеткой (стадия клеточного цикла G0) либо при инфицировании клетки вирусом с изменёнными (дефектными) свойствами. Следует различать дефектные вирусы и дефектные вирионы. Первые существуют как самостоятельные виды и функционально неполноценны, так как для их репликации необходим «вирус-помощник» (например, для репликации аденоассоциированного вируса необходимо присутствие аденовирусов). Вторые составляют дефектную группу, формирующуюся при образовании больших дочерних популяций (например, могут образовываться пустые капсиды либо безоболочечные нуклео-капсиды). Особая форма дефектных вирионов — псевдовирионы, включившие в капсид нуклеиновую кислоту клетки-хозяина.
Интерференция вирусов происходит при инфицировании клетки двумя вирусами. Различают гомологичную (при инфицировании клетки родственными вирусами) и гетерологичную (если интерферируют неродственные виды) интерференцию. Это явление возникает не при всякой комбинации возбудителей, иногда два разных вируса могут репродуцироваться одновременно (например, вирусы кори и полиомиелита). Интерференция реализуется либо за счёт индукции одним вирусом клеточных ингибиторов (например, ИФН), подавляющих репродукцию другого, либо за счёт повреждения рецепторного аппарата или метаболизма клетки первым вирусом, что исключает возможность репродукции второго.
Бактериофаги. Особенности взаимодействия фага с бактериальной клеткой. Умеренные и вирулентные бактериофаги. Лизогения.
Бактериофаги
-Обозначают буквами латинского, греческого или русского алфавита с цифровым индексом после названия вида бактерии: E. coli Т2.
-По специфичности взаимодействия различают поливалентные (инфицируют родственные виды бактерий), моновалентные (инфицируют определенный вид бактерий), типовые фаги (инфицируют отдельные варианты бактерий).
Вирулентные фаги взаимодействуют с бактерией по продуктивному типу.
- Умеренные фаги взаимодействуют с бактериями по продуктивному или по интегративному типу.
При интегративном типе взаимодействия ДНК фага (профаг) встраивается в хромосому бактерии и передается ее потомству, такая культура бактерий называется лизогенной, сосуществование фага и бактерии – лизогенией. В основе процесса лежит синтез бактериальной клеткой спец. репрессора, кот подавляет транскрипцию фаговых генов.
Лизогенные бактерии приобретают иммунитет к последующему заражению гомологичными или близкородственными фагами.
Профаги лизогенной культуры бактерий могут спонтанно депрессироваться и переходить в вегетативное состояние, что заканчивается продукцией фагов и лизисом бакт. клеток. Частота спонтанного лизиса невелика (10-2, 10-6), ее можно увеличить при действии УФ лучей, иониз. излучения, перекисных соединений и др.
Геном профага может придавать бактерии новые свойства (фаговая конверсия): морфологические, культуральные, биохимические, антигенные и др.
-Умеренные фаги могут быть дефектными
Применение фагов
В лабораторной диагностике при видовой идентификации патогенных бактерий – определение фаговара (фаготипирование). Эту методику используют для выявления источника и путей распространения инфекции (эпидемиологическое маркирование) – выявление патогенов одного фаговара от разных больных указывает на общий источник заражения.
При эпидемиологическом анализе вспышек инф. болезней (по содержанию фагов в воде судят о присутствии в ней патогенов).
Для лечения и профилактики инф. заболеваний (брюшнотифозный, сальмонеллезный, дизентерийный, стафилококковый, стрептококковый и др. фаги).
В генной инженерии в качестве векторов-переносчиков трансгенов.
Методы культивирования вирусов. Применение вирусов и бактериофагов в биотехнологии, микробиологии и медицине.
Особенности генетики вирусов. Генетическая рекомбинация, генетическая реактивация, комплементация, фенотипическое смешивание.
Нормальная микрофлора организма человека и ее функции. Дисбиозы. Дисбактериозы. Препараты для восстановления нормальной микрофлоры: пробиотики, эубиотики.
Микрофлора воды, качественный состав и значение. Методы санитарно-микробиологического исследования воды. Нормативы, санитарно-показательные микроорганизмы. Вода как фактор передачи инфекционных заболеваний.
Микрофлора воздуха, качественный состав и значение. Методы санитарно-микробиологического исследования микрофлоры воздуха. Нормативы, санитарно-показательные микроорганизмы. Воздух закрытых помещений как фактор передачи инфекционных заболеваний.
Микрофлора почвы. Почва как фактор передачи инфекционных заболеваний. Санитарно-микробиологическое исследование почвы. Нормативы, санитарно-показательные микроорганизмы.
Методы санитарно-микробиологического исследования микрофлоры продуктов питания и лекарственных средств.
Санитарно-микробиологическое исследование предметов окружающей среды. Исследование смывов с рук, инвентаря, оборудования.
Противомикробные препараты. Антибиотики: источники, классификация по химической структуре, механизму, спектру и типу действия. Способы получения.
Синтетические противомикробные, противогрибковые и противовирусные препараты, классификация, механизмы и спектр действия. Механизмы лекарственной устойчивости возбудителей инфекционных болезней. Пути ее преодоления.
Принципы рациональной антибиотикотерапии. Осложнения антибиотикотерапии, их предупреждение.
Методы определения чувствительности бактерий к противомикробным препаратам.
Понятие об инфекции. Инфекционный процесс и инфекционная болезнь. Условия возникновения инфекционного процесса. Стадии и уровни инфекционного процесса.
Роль реактивности организма в возникновении и развитии инфекционного процесса. Влияние биологических и социальных факторов на реактивность организма.
Патогенность и вирулентность бактерий. Патогенные, условно-патогенные и сапрофитные микроорганизмы. Факторы патогенности.
Токсины бактерий, их природа, свойства, получение. Генетическая регуляция токсинообразования.
Особенности формирования патогенности у вирусов. Особенности вирусных инфекций.
Иммунная система человека. Центральные и периферические органы иммунной системы. Основные принципы и механизмы функционирования иммунной системы.
Понятие об иммунитете. Виды иммунитета Видовой (наследственный) иммунитет.
