
- •Тема 1. Асептика в биотехнологических процессах
- •Элементы асептики в биотехнологии
- •I. Физические методы стерилизации
- •Экспериментальная часть
- •Расчетно-аналитическая часть
- •Контрольные вопросы
- •Литература
- •Тема 2. Метаболизм углеродсодержащего субстрата. Способы культивирования дрожжей на различных углеродных субстратах
- •Биохимические особенности роста микроорганизмов на углеродных субстратах
- •Стехиометрия процессов культивирования микроорганизмов
- •Формула биомассы микроорганизмов. Молекулярный вес биомассы (биомоль)
- •Экспериментальная часть
- •Подготовка посевного материала
- •Приготовление питательных сред
- •Построение калибровочного графика
- •Условия культивирования
- •Методы аналитических исследований
- •Расчетно-аналитическая часть
- •Контрольные вопросы
- •Литература
- •Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования
- •Описание кинетики ферментативных реакций
- •Описание кинетики микробного роста
- •Экспериментальная часть
- •Расчетно-аналитическая часть
- •Контрольные вопросы
- •Литература
- •Расчетные задания к практическим занятиям
- •Примерные темы самостоятельных работ к семинарским занятиям
Литература
Бирюков В.В. Основы промышленной биотехнологии. – М.: КолосС, 2004. – 296 с.
Елинов Н.П. Основы биотехнологии. – С-Пб.: Наука, 1995. – 600 с.
Кантере В.М. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – 271 с.
Манаков М.Н., Победимский Д.Г. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – с. 210-213.
Матвеев В.Е. Научные основы микробиологической технологии. – М.: Агропромиздат, 1985. – 224 с.
Матвеев В.Е. Основы асептики в технологии чистых микробиологических препаратов. – М.: Легкая и пищевая пром-сть, 1981. – 312 с.
Биотехнология: уч. пособие для вузов. В 8 кн. / Под ред. Н.С. Егорова; В.Д. Самуилова. Кн. 1. – М.: Высшая школа, 1987. – 159 с.
Беккер М.Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология. – М.: Агропромиздат, 1990. – 334 с.
Промышленная микробиология / Под ред. Н.С. Егорова. – М.: Высшая школа, 1989. – 688 с.
Тема 2. Метаболизм углеродсодержащего субстрата. Способы культивирования дрожжей на различных углеродных субстратах
Живая клетка – сложный биохимический реактор для проведения более 1000 независимых одновременно протекающих биокаталитических процессов превращения веществ, совокупность которых называется метаболизмом клетки.
Процессы метаболических превращений сложных веществ (полисахаридов, липидов, белков и др.) в простые (например, СО2 и Н2О) с целью получения энергии (для энергетического обмена) называются катаболическими, а их совокупность – катаболизмом клетки.
Процессы метаболических превращений с целью построения клетки с биосинтезом белков, нуклеиновых кислот, липидов, полисахаридов и др. сложных, богатых энергией веществ из простых (для конструктивного обмена) являются энергопотребляющими и называются анаболическими, а их совокупность – анаболизмом клетки.
Процессы биосинтеза низкомолекулярных веществ – аминокислот, нуклеотидов, моносахаридов – компонентов для биосинтеза биополимеров - белков, нуклеиновых кислот, липидов, полисахаридов называются амфиболическими, а их совокупность – амфиболизмом клетки. Амфиболические процессы обеспечивают клетку энергией и исходными для анаболизма веществами.
Метаболические процессы и реакции в клетке объединяются в определенные последовательности, называемые путями метаболизма.
В результате анаболизма и амфиболизма синтезируются первичные и вторичные метаболиты.
Первичные метаболиты – это продукты метаболизма, необходимые для роста микроорганизмов и выступающие в качестве строительных блоков макромолекул и коферментов. К ним относятся аминокислоты, витамины, ферменты, органические кислоты и др.
Вторичные метаболиты – это продукты метаболизма, в которых микроорганизмы не нуждаются для собственного роста. К ним относятся антибиотики, токсины, алкалоиды и др.
Биохимические особенности роста микроорганизмов на углеродных субстратах
В биотехнологии под субстратом понимается органическое или неорганическое вещество, взаимодействующее с ферментом с образованием фермент-субстратного комплекса, в результативном случае приводящего к получению продуктов ферментативной реакции.
При этом следует заметить, что для описания природных процессов понятие «субстрат» (substrate) используется двояко: под ним понимается не только питательное вещество для организмов, но и среда, обусловливающая условия для их роста и развития (например, буковая стружка для иммобилизованных клеток уксусно-кислых бактерий).
Подавляющее большинство микроорганизмов в качестве углеродного субстрата предпочитают использовать углеводы – моно- и дисахариды, прежде всего гексозы (глюкозу, фруктозу, галактозу, мальтозу, сахарозу и др.).
Природа микроорганизма обусловливает выбор одного из путей катаболизма глюкозы в качестве доминирующего пути: Эмбдена-Мейергофа-Парнаса, пентозофосфатный, Энтнера-Дудорова, дыхание и др.
Метаболический путь Эмбдена-Мейергофа-Парнаса (ЭМП)
Катаболизм глюкозы по пути ЭМП включает 10 биокаталитических стадий (рис. 2.1).

Рис. 2.1 – Схема метаболического пути Эмбдена-Мейергофа-Парнаса
Исходным субстратом является глюкоза, конечным продуктом – пировиноградная кислота (ПВК, пируват). Катаболизм глюкозы состоит в ее фосфорилировании, а также фосфорилировании промежуточных соединений с накоплением максимума энергии субстрата внутри клетки, поскольку сильно ионизированные органические вещества не диффундируют через клеточную мембрану из клетки и являются источником энергии для конструктивного и энергетического обмена. Накопление внутриклеточной энергии вследствие присоединения фосфатной группы HPO42- к молекулам органического субстрата называют субстратным фосфорилированием.
В процессе катаболизма глюкозы осуществляются энергозатратные реакции, когда изменение свободной энергии ∆G≥0; энергодающей реакцией для их протекания является сопряженная реакция гидролиза АТФ (рис. 2.1). Спонтанные реакции фосфорилирования АДФ с образованием АТФ осуществляются, начиная с превращения двух молекул 3‑фосфоглицеринового альдегида через ряд промежуточных продуктов в две молекулы пирувата (рис. 2.1). Таким образом, катаболизм 1 молекулы глюкозы с образованием 2 молекул пирувата сопровождается первоначальным гидролизом 2 молекул АТФ и последующим образованием 4 молекул АТФ.
Общая стехиометрия пути ЭМП выглядит следующим образом:
С 6Н12О6
+ 2Рi
+ 2АДФ + 2НАД+
2С3Н4О3
+ 2АТФ + 2(НАДН+Н+)
(2.1)
6Н12О6
+ 2Рi
+ 2АДФ + 2НАД+
2С3Н4О3
+ 2АТФ + 2(НАДН+Н+)
(2.1)
Глюкоза ПВК
В результате катаболизма глюкозы по пути ЭМП клетка получает следующие преимущества:
- запасается химическая энергия (АТФ)
- образуются восстанавливающие эквиваленты (НАДН+Н+)
- синтезируются биосинтетические предшественники (ПВК).
Поэтому этот путь метаболизма является амфиболическим.
В клетках мышечных тканей и молочно-кислых бактериях путь ЭМП не завершается образованием пирувата; пируват восстанавливается до молочной кислоты (лактата):
С 3Н4О3 + НАДН + Н+ С3Н6О3 + НАД+ (2.2)
пируват лактат
Вся последовательность биохимических реакций, начинающая с глюкозы и завершающаяся молочной кислотой называется гликолизом.
В зависимости от потребностей в важнейших биосинтетических предшественниках метаболизма (пирувата, ацетилкофермента А, органических кислотах), в энергии (АТФ и других макроэргических соединениях), в восстановительных эквивалентах (НАДН и НАДФН) микробные клетки могут использовать и другие пути метаболизма, например, пентозофосфатный, Энтнера-Дудорова, дыхание.
При этом общий принцип метаболизма субстратов состоит в том, что клетки могут использовать субстрат, пользуясь несколькими путями катаболизма одновременно для обеспечения своего оптимального развития за счет удовлетворения потребностей в энергии и в синтезе предшественников биополимеров.
Метаболизм этанола
Первичное окисление этанола осуществляется последовательно двумя ферментами: НАД-зависимой алкогольдегидрогеназой и НАД-зависимой дегидрогеназой. Первый фермент локализован в митохондриях и ответственен за проведение реакций окисления этанола в ацетальдегид:

В цитоплазме обнаружен еще один тип дегидрогеназы, которая катализирует протекание обратной реакции превращения ацетальдегида в этанол. Этот процесс обычно отмечается для анаэробных условий, в которых протекает спиртовое брожение, в то время как реакция (2.3) доминирует при аэробном росте дрожжей на этаноле.
Ацетальдегид, в свою очередь, под действием НАД-зависимой дегидрогеназы превращается в ацетилкофермент А (СН3СОКоА, ацетил‑КоА):
(2.4)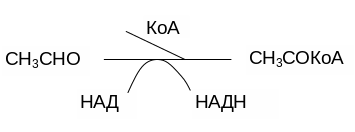
В результате двухступенчатого окисления этанола образуется 2 моля НАДН из 1 моля этанола. При недостатке кислорода клетка может выделять в окружающую среду уксусную кислоту. Она образуется за счет конверсии ацетилкофермента А с участием неорганического фосфата под действием фосфатацетилтрансферазы до фосфоацетилфосфата (СН3СООФ) и дальнейшего превращения последнего в уксусную кислоту под действием ацетаткиназы:
(2.5)
При аэробном дыхании на окисление 1 моля этанола затрачивается 1 моль кислорода и синтезируется 5 молей АТФ.
Ацетилкофермент А, синтезированный в клетке в нормальных условиях, включается в ЦТК при конденсации с оксокислотами. Часть ацетил-КоА вовлекается в так называемый глиоксилатный шунт. Глиоксилатный шунт представляет собой обходной путь реакций превращения изолимонной кислоты в яблочную (рис. 2.2). Если в цикле Кребса изолимонная кислота путем двух стадий декарбоксилирования последовательно превращается через α‑кетоглютаровую кислоту в янтарную кислоту, а затем в яблочную, то при окислении этанола с «включением глиокси-латного шунта» эти две стадии декарбоксилирования отсутствуют.
Изолимонная кислота путем альдольного расщепления превращается в янтарную и глиоксиловую кислоты. Эту реакцию катализирует изоцитратлиаза. Глиоксиловая кислота путем конденсации с ацетил-КоА образует яблочную кислоту под действием малатсинтазы. Таким образом, при каждом обороте цикла за счет включения второй молекулы ацетил-КоА синтезируются дополнительные молекулы яблочной кислоты (рис. 2.2). Она используется клеткой для биосинтеза фосфоенолпирувата с «замыканием» метаболических путей утилизации источников углерода.
Конденсация
с глиоксиловой кислотой
+ Ацетил-КоА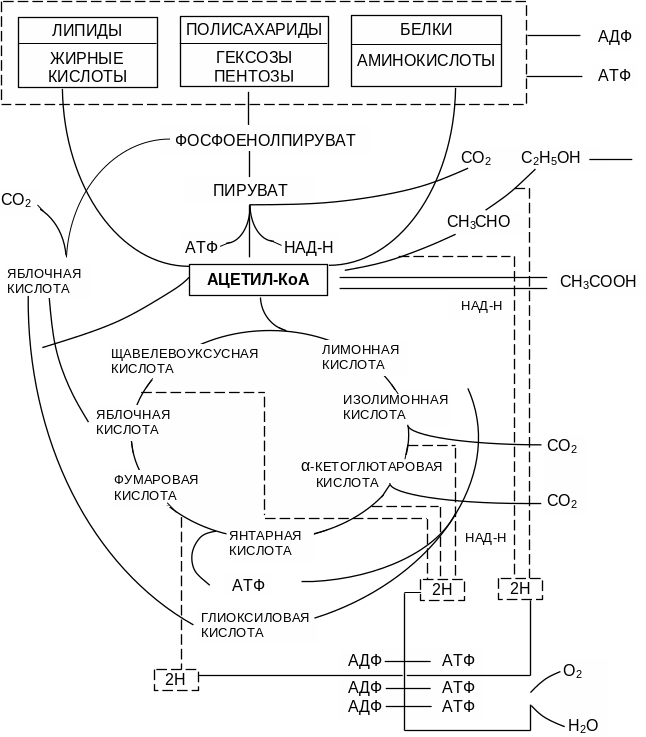
Рис. 2.2 – Биохимическая схема ассимиляции
углеродных субстратов дрожжами
На рис. 2.2 отмечена передача четырех пар протонов (2Н), высвобождающихся в цикле ЦТК при катаболизме углеводов, в электронтранспортную цепь (ЭТЦ) дыхания с их окислением до Н2О.
При ассимиляции этанола в ЭТЦ дополнительно передается 2 пары протонов (2Н).
Сопряженно с транспортом электронов в дыхательной цепи протекает процесс регенерации АТФ и, как следствие, накапливается внутриклеточная энергия. Этот процесс называется окислительным фосфорилированием.
