
- •1 Вопрос классификация неорганических веществ
- •2 Вопрос Основные понятия химии
- •3 Вопрос Закон сохранения массы вещества. Закон постоянства состава. Закон Авогадро. Молярный объем. Число Авогрдо.
- •4 Вопрос Закон эквивалентов. Определение молярных массэквивалентов солей, оснований, кистот, элементов
- •6 Вопрос Основные сведения о строении атомов. Протон, нейтрон,электрон. Квантовые числа. Максимальное число электронов на энергетических уровнях и полдуровнях.
- •8 Вопрос Периодический закон Менделеева. Структура периодической системы.
- •9 Вопрос Определение свойств элементов по строению электронных оболочек атомов.
- •10 Вопрос Периодическое изменение свойств химических элементов (атомные радиусы, степень окисления, вост и окисл свойства эелементов и простых веществ, свойства оксидов и гидроксидов )
- •11 Вопрос. Энергия ионизации. Сродство электрону. Электроотрицательность.
- •12 Вопрос. Химическая связь. Металлическая связь. Ионная связь
- •13 Вопрос Ковалентная связь.
- •14 Вопрос Водородная связь. Донорно-акцепторная связь.
- •15 Вопрос Межмолекулярное взаимодействие.
- •16 Вопрос. Скорость хим. Реакций. Гомогенные и гетерогенные системы.
- •17 Вопрос. Зависимость скорости гомогенных реакций от концентрации реагирующих веществ. Закон действия масс.
- •18 Вопрос. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •19 Вопрос. Гомогенные и гетерогенный катализ.
- •20 Вопрос. Обратимые реакции. Химическое равновесие. Константа химического равновесия.
- •21 Вопрос. Смещение химического равновесия. Принцип Ле Шателье.
- •22 Вопрос. Энергетика хим. Реакций. Внутренняя энергия. Энтальпия. Энтропия. Термохим уравнения. Закон Гесса. Следствие из закона Гесса.
- •1 Следствие
- •2 Следствие
- •Лавуазье-Лапласа: тепловой эффект образования химических соединений равен, но обратен по знаку тепловому эффекту его разложения.
- •Гесса: тепловой эффект реакции при постоянном давлении или объеме зависит только от начального и конечного состояния системы и не зависит от пути перехода.
- •23 Вопрос. Энергия Гиббса. Направленность хим. Процессов. Анализ уравнения Гиббса.
- •24 Вопрос. Растворы. Растворимость веществ. Энергетика растворения. Общие свойства растворов(осмос, понижение и повышение температуры замерзания и кипения растворов)
- •25 Вопрос. Состав растворов. Способы выражения состава раствор (безразмерные, концентрации)
- •30Вопрос . Ионные уравнения реакций
- •32 Вопрос.Диссоциация воды
- •33 Вопрос. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
- •Вопрос . Степень гидролиза
- •36Вопрос. Окисли́тельно-восстанови́тельные
- •41 Вопрос . Электрохимическая коррозия
- •1) Гомогенный механизм электрохимической коррозии:
- •2) Гетерогенный механизм электрохимической коррозии:
- •44 Вопрос . Вода в природе
- •46 Вопрос.
- •49 Вопрос .
- •50Вопрос .
- •51 Вопрос .
- •53. Неорганические вяжущие вещества
6 Вопрос Основные сведения о строении атомов. Протон, нейтрон,электрон. Квантовые числа. Максимальное число электронов на энергетических уровнях и полдуровнях.
Химический элемент может существовать в трёх формах:свободные атомы, простые вещества, сложные вещества. Атомы-это химические частицы, являющиеся пределом химического разложения любого вещества. Атомы не делимы химическим путём. Масса атомов разных видов составляет порядка10-24-10-22г, размеры атомов колеблются в пределах 1·10-10-5·10-10 м ,поэтому атомы считаются мельчайшими химическими частицами. Атомы одного вида являются атомами одного химического элемента, атомы разных видов-атомами разных химических элементов. Каково же строение атома? По современным представлениям атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательные электроны.Строение атома можно представить в виде, так называемой, планетарной модели, которую предложил Эрнест Резерфорд. Она представляет собой мини-солнечную систему, где в центре находится ядро (Солнце), вокруг которого вращаются электроны (планеты солнечной системы).
![]()
Основная масса атома сосредоточена в ядре, которое состоит из частиц двух видов: протонов инейтронов. Протоны имеют заряд, равный заряду электрона, но противоположный по знаку (+), и массу, равную массе углерода или 1/12 массы углерода (эта единица называется атомная единица массы, с которой мы познакомимся попозже). Протоны обозначаются знаком р+. Нейтроны не имеют заряда, то есть они электронейтральны, и имеют массу примерно равную массе протона, т.е. 1. Обозначают n0. Сумма числа протонов и нейтронов называется массовым числом. Так как атом электронейтрален, то число протонов и электронов в атоме одинаково. Массой электронов можно пренебречь, то можно считать, что вся масса атома сосредоточена в ядре. Число протонов и нейтронов научимся определять, после того как изучим периодическую систему химии.
Порядковый номер элемента- заряд его элемента.
Следоваельно, порядковый номер хим. Элемента совпадает с зарядом ядра его атома.Заряд атома- основная хар-ка элемента.
Свойства хим. Элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.
Изотопы- разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов., т.е. разные массовые числа.
Протон, нейтрон,электрон.
Ядро состоит из частиц двух типов: протонов и нейтронов. Протоны несут положительный заряд и притягивают отрицательно заряженные электроны. Ядро может удержать более 100 электронов, так почему же все эти положительные заряды не отталкивают друг друга, почему атом не разваливается? Потому что частицы ядра удерживаются вместе мощными силами, существующими только внутри атома, - так называемыми сильными взаимодействиями. Нейтроны подобны протонам, но они не несут никакого заряда. Нейтрон может расщепиться, «выбросить» электрон и превратиться в протон. В большинстве атомов содержится примерно столько же нейтронов, сколько протонов, а в тяжелых атомах они находятся в избытке. Эти «лишние» нейтроны увеличивают сильные взаимодействия, удерживающие протоны вместе. Свободный нейтрон (вне атома) живет 886 секунд и затем расщепляется. Электроны движутся вокруг ядра в его электростатическом поле. Раньше ученые полагали, что в своем движении они аналогичны планетам, обращающимся вокруг Солнца, но все оказалось гораздо сложнее. Электрон никогда не находится в данный момент времени в определенном месте. Он с какой-то вероятностью пребывает одновременно во многих местах, размываясь, как облако. И что еще более любопытно -электрон может перейти на новую орбиту одним квантовым скачком, а не точка за точкой.ческих элементов.
Квантовые числа
Квантовые характеристики электрона. Теория Бора приписывала четырем электронным оболочкам К, L, M и N квантовое число и, равное соответственно 1, 2, 3 и 4. Эти числа соответствуют повышающимся энергетическим уровням оболочек.
Однако внимательное рассмотрение атомных спектров показывает, что линии, обусловленные переходами между такими квантовыми энергетическими уровнями, на самом деле расщеплены на более тонкие линии. Это указывает, что электронные оболочки в действительности расщеплены на подоболочки, каждая со своим собственным квантовым энергетическим уровнем. Электронные подоболочки получили обозначения по типам соответствующих им линий в атомных спектрах, а именно:
s-подоболочка названа по «резкой» (sharp) s-линии р-подоболочка названа по «главной» (principal) р-линии d-подоболочка названа по «диффузной» (diffuse) d-линии f-подоболочка названа по «фундаментальной» (fundamental) f-линии
s-Подоболочка состоит из одной s-орбитали. р-Подоболочка состоит из трех р-орбиталей (см. рис. 1.18), а d-подоболочка-из пяти d-орбиталей.
Линии, обусловленные переходами между этими подоболочками, испытывают дальнейшее расщепление, если атомы элементов помещены во внешнее магнитное поле. Это расщепление называется эффектом Зеемана. Экспериментально установлено, что указанное расщепление возможно только для р-, d- и f-подоболочек. Каждый энергетический уровень, на который они расщепляются в магнитном поле, соответствует одной орбитали в подоболочке. Магнитное поле не оказывает влияния на s-подоболочку, так как она состоит всего из одной s-орбитали сферической формы.
В отсутствие магнитного поля все орбитали одной подоболочки имеют одинаковую энергию. Орбитали, имеющие одинаковую энергию, называются вырожденными.
Атомные спектры элементов при определенных условиях обнаруживают расщепление, обусловленное наличием у электрона особого свойства -спина, которое можно представить себе как вращение электрона вокруг собственной оси. По направлению это вращение может быть правосторонним (по часовой стрелке) либо левосторонним (против часовой стрелки).
Таким образом, энергетический уровень электрона в атоме определяется следующими четырьмя характеристиками: оболочкой, подоболочкой, орбиталъю и спином. Каждой из этих характеристик сопоставляется определенное квантовое число.
Четыре квантовых числа. Главное квантовое число (и). Это квантовое число характеризует оболочку, в которой находится электрон. Оно может принимать значения
Чем больше значение и, тем выше энергетический уровень оболочки. Вспомогательное (орбитальное) квантовое число (l). Это квантовое число характеризует подоболочку, на которой находится электрон. Оно может принимать значения
l = 0, 1, ...,n- 1
где n-главное квантовое число. В подоболочке с орбитальным квантовым числом / содержится 21 + 1 орбиталей. Например,
![]()
На рис. 1.21 показано относительное расположение энергетических уровней всех s-, р- и d-подоболочек, принадлежащих первым четырем электронным оболочкам. Важно обратить внимание на особенность 48-подоболочки: ее энергетический уровень располагается ниже уровня 3<1-под обол очки.
Магнитное квантовое число (т). Как было указано выше, все орбитали одной подоболочки в обычных условиях имеют вырожденные (одинаковые) значения энергии. Однако под влиянием внешнего магнитного поля орбитальные энергии становятся дискретными, или квантовыми.
Спиновое квантовое число (s). Спиновое квантовое число электрона может принимать только одно из двух значений: + 1I1 либо —1I2.
Возможные значения четырех квантовых чисел для всех электронов, которые могут располагаться на первых трех оболочках, приведены в табл. 1.5. Следует отметить, что каждый электрон имеет свой индивидуальный набор квантовых чисел, которым он отличается от всех других электронов данного атома.
Таблица 1.5. Квантовые числа


Рис. 1.21. Диаграмма электронных энергетических уровней атома.
Максимальное число электронов
Электронный слой, или энергетический уровень – это совокупность электронов с близкими значениями энергии.
Максимальное число электронов, которые могут находиться на том или ином электронном уровне, определяется по формуле:
N = 2n2
N – максимальное число электронов на уровне; n – номер энергетического уровня.
По этой формуле понятно, что на первом энергетическом уровне может находиться не более 2 электронов (2 х 12) , на втором – не более 8 (2х22), на третьем – не более 18 (2х32) и т.д.
Но на внешнем энергетическом уровне может находиться не более 8 электронов.
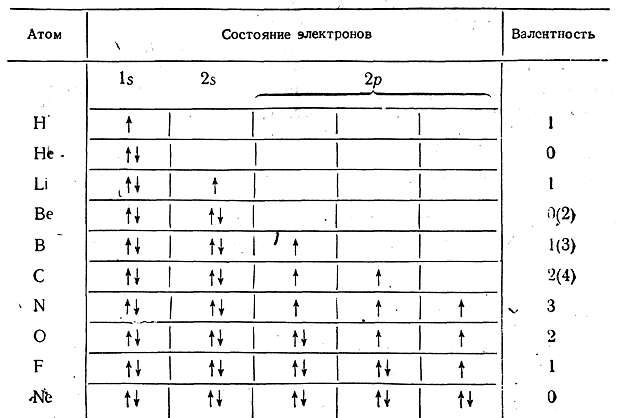
7 вопрос Строение электронных оболочек атомов. Порядок заполнения электронных уровней и подуровней . способы изображения строения электронных оболочек(электронные формулы и графический способ). Правило Гунда
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
В разделе "Сведения о строении атома" вы познакомились с планетарной моделью атома, согласно которой вокруг положительного ядра движутся электроны, которые образуют электронные оболочки атома. Электроны различаются своей энергией, чем дальше от ядра расположены электроны тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома. Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N-число электронов на слое, n-номер слоя. Произведя простые рассчёты, выясним что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это небходимо учитывать при распределении электронов по энергетическим слоям. Рассмотрим несколько примеров заполнения электронных оболочек.
![]()
После заполнения второго слоя до восьми электронов появляется третий слой.
![]()
![]()
Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов.
![]()
Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой. Распределение электронов по уровням можно записать с помощью ячеек Хунда:

Здесь уровни разделены на подуровни. Вы наверное заметили, что в периодической системе элементы подразделяются на s-, p-, d-, f-элементы. Какой подуровень заполняется последним, к такой группе и относится данный элемент. Например, последний электрон занимает одну из р-орбиталей, то этот элемент относится к р-элементам. При заполнении ячеек электроны обозначаются стрелками (одна стрелка направлена вверх, другая вниз, это связано с тем, что электроны вращаются вокруг своей оси-один по часовой, другой-против часовой стрелки), причём в одной ячейке могут находиться не более двух электронов.
Порядок заполнения ячеек.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p |
При заполнении ячеек следует учитывать то,что ячейки подуровней заполняются вначале по одному электрону, затем к ним помещают другие электроны.
![]()
Увеличение числа электронов в атоме подчиняется определенным законам, что приводит к строгому расположению элементов в периодической таблице Д.И.Менделеева и периодическому повторению их свойств. Ранее не раз упоминались некоторые основные положения электронного строения атомов. Повторим их и кратко рассмотрим новые. 1. Подобие энергетических электронных уровней атомов уровням атома водорода. Поскольку точный расчет электронного строения двух- и многоэлектронных атомов пока невозможен, предполагается, что их электронные уровни и подуровни расположены, как в атоме водорода. Это предположение имеет исключения. 2. Принцип наименьшей энергии. При заполнении электронами уровней и подуровней последовательность размещения электронов должна отвечать как наименьшей энергии электрона, так и наименьшей энергии атома в целом. Электрон не занимает вышележащий уровень, если в нижележащем есть ячейки, располагаясь в которых, он будет обладать меньшей энергией. Этот принцип выражает общее термодинамическое требование к устойчивости системы: максимуму устойчивости системы соответствует минимум ее энергии. Но помните также и о том, что в состоянии максимальной устойчивости электронной системы в атоме связь электронов с ядром наиболее прочна. Чем ближе к ядру находится электрон, тем прочнее его связь с ядром. 3. Правило n + l, или правило Клечковского. Энергия электрона в атоме определяется значениями главного n и побочного l квантовых чисел, поэтому сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений квантовых чисел n + l минимальна. Если для двух подуровней одного или разных уровней суммы n + l равны, то сначала заполняется подуровень с меньшим значением n. 4. Правило Гунда (Хунда). Заполнение электронами ячеек p-, d- и f-подуровней вначале происходит неспаренными электронами, и лишь после такого заполнения подуровня начинается вхождение в ячейки вторых электронов (с противоположными спиновыми квантовыми числами), т. е. происходит их спаривание.
Спокойная очередь входит в пустой автобус. Каждый пассажир вначале занимает одно место двухместного сиденья, а когда такие места заканчиваются, пассажиры начинают подсаживаться на свободные места к уже сидящим. В столовой почему-то вы выбираете столик, за которым никто не сидит, но, когда таких столиков нет, вы подсаживаетесь вторым. Неужели законы квантовой механики сказываются на поведении людей? Принцип Паули и правило Гунда свидетельствуют о неизвестном и непонятном нам информационном взаимодействии между электронами. Каждый электрон как будто знает о состоянии другого электрона в атоме (и, наверное, в молекуле).
5. Повышенная устойчивость подуровней. Незаполненные, наполовину заполненные и полностью заполненные подуровни обладают повышенной устойчивостью. На рис. 4.5 показан порядок заполнения электронных уровней и подуровней многоэлектронных атомов, найденный при подсчете сумм n + l, с учетом других теоретических положений
.
![]()
Рис. 4.5. Порядок заполнения электронных уровней и подуровней многоэлектронных атомов
Порядок заполнения уровней и подуровней электронами.
I. Электронные формулы атомов химических элементов составляют в следующем порядке:
· Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
· Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
· Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
· Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
1. у элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
2. у элементов побочных подгрупп на внешнем уровне обычно два электрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне ноль электронов);
3. число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
 электнонный
формулы ,изображения строения электронных
оболочек
электнонный
формулы ,изображения строения электронных
оболочек
 графически
графически

