
- •1 Вопрос классификация неорганических веществ
- •2 Вопрос Основные понятия химии
- •3 Вопрос Закон сохранения массы вещества. Закон постоянства состава. Закон Авогадро. Молярный объем. Число Авогрдо.
- •4 Вопрос Закон эквивалентов. Определение молярных массэквивалентов солей, оснований, кистот, элементов
- •6 Вопрос Основные сведения о строении атомов. Протон, нейтрон,электрон. Квантовые числа. Максимальное число электронов на энергетических уровнях и полдуровнях.
- •8 Вопрос Периодический закон Менделеева. Структура периодической системы.
- •9 Вопрос Определение свойств элементов по строению электронных оболочек атомов.
- •10 Вопрос Периодическое изменение свойств химических элементов (атомные радиусы, степень окисления, вост и окисл свойства эелементов и простых веществ, свойства оксидов и гидроксидов )
- •11 Вопрос. Энергия ионизации. Сродство электрону. Электроотрицательность.
- •12 Вопрос. Химическая связь. Металлическая связь. Ионная связь
- •13 Вопрос Ковалентная связь.
- •14 Вопрос Водородная связь. Донорно-акцепторная связь.
- •15 Вопрос Межмолекулярное взаимодействие.
- •16 Вопрос. Скорость хим. Реакций. Гомогенные и гетерогенные системы.
- •17 Вопрос. Зависимость скорости гомогенных реакций от концентрации реагирующих веществ. Закон действия масс.
- •18 Вопрос. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •19 Вопрос. Гомогенные и гетерогенный катализ.
- •20 Вопрос. Обратимые реакции. Химическое равновесие. Константа химического равновесия.
- •21 Вопрос. Смещение химического равновесия. Принцип Ле Шателье.
- •22 Вопрос. Энергетика хим. Реакций. Внутренняя энергия. Энтальпия. Энтропия. Термохим уравнения. Закон Гесса. Следствие из закона Гесса.
- •1 Следствие
- •2 Следствие
- •Лавуазье-Лапласа: тепловой эффект образования химических соединений равен, но обратен по знаку тепловому эффекту его разложения.
- •Гесса: тепловой эффект реакции при постоянном давлении или объеме зависит только от начального и конечного состояния системы и не зависит от пути перехода.
- •23 Вопрос. Энергия Гиббса. Направленность хим. Процессов. Анализ уравнения Гиббса.
- •24 Вопрос. Растворы. Растворимость веществ. Энергетика растворения. Общие свойства растворов(осмос, понижение и повышение температуры замерзания и кипения растворов)
- •25 Вопрос. Состав растворов. Способы выражения состава раствор (безразмерные, концентрации)
- •30Вопрос . Ионные уравнения реакций
- •32 Вопрос.Диссоциация воды
- •33 Вопрос. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
- •Вопрос . Степень гидролиза
- •36Вопрос. Окисли́тельно-восстанови́тельные
- •41 Вопрос . Электрохимическая коррозия
- •1) Гомогенный механизм электрохимической коррозии:
- •2) Гетерогенный механизм электрохимической коррозии:
- •44 Вопрос . Вода в природе
- •46 Вопрос.
- •49 Вопрос .
- •50Вопрос .
- •51 Вопрос .
- •53. Неорганические вяжущие вещества
25 Вопрос. Состав растворов. Способы выражения состава раствор (безразмерные, концентрации)
Способы выражения состава растворов.
Основные понятия: растворимость, растворитель, растворенное вещество.
Растворимость – способность вещества растворяться в том или ином растворителе.
Растворитель – компонент раствора, агрегатное состояние которого не изменяется при образовании раствора.
Растворенное вещество – компоненты раствора за исключением растворителя.
Классификация растворов (по содержанию растворенного вещества, по агрегатному состоянию).
Насыщенный раствор – термодинамически устойчивая равновесная система, в которой скорость растворения вещества равна скорости выделения его из раствора.
Ненасыщенный раствор – термодинамически устойчивая неравновесная система, в которой концентрация вещества меньше, чем в насыщенном растворе, и поэтому скорость растворения больше скорость выделения.
Пересыщенный раствор – термодинамически неустойчивая псевдоравновесная система, в которой концентрация вещества больше, чем в насыщенном растворе, и поэтому скорость выделения больше скорости растворения.
Концентрированный раствор – раствор с высоким содержанием растворенного вещества.
Разбавленный – с низким содержанием растворенного вещества.
Гомогенные растворы – истинные растворы.
Гетерогенные растворы – коллоидные растворы
Гомогенные и гетерогенные растворы.
Гомогенные растворы – истинные растворы.
Гетерогенные растворы – коллоидные растворы
Понятия: фаза, компонент раствора.
Фаза – совокупность однородных микрообластей, характеризующихся одинаковой упорядоченностью и концентрацией частиц и заключенных в макроскопическом объеме вещества, ограниченном поверхностью раздела.
Компонент раствора – вещество, составляющее раствор.
Определение и формулы расчета для следующих видов концентраций: массовая, объемная и мольная доли, моляльность, массовая концентрация, титр, молярная концентрация и молярная концентрация эквивалента.
Массовая доля – отношение массы растворенного вещества к массе раствора
ω(в-ва) = m(в-ва)/m(р-ра)
Объемная доля – отношение объема газа к объему всей смеси газов
φ(газа) = V(газа)/V(смеси)
Мольная доля – отношение количества вещества в сумме количеств вещества и растворителя
χ(в-ва) = n(в-ва)/(n(в-ва)+n(р-ра))
Моляльная концентрация, или моляльность – отношение количества вещества к массе растворителя
B(в-ва) = n(в-ва)/m(р-ля) (моль/кг)
Массовая концентрация – отношение массы вещества к объему раствора
Р(в-ва) = m(в-ва)/V(р-ра) (г/л)
Титр – масса растворенного в-ва в 1 мл раствора
Т(в-ва) = m(в-ва)/V(р-ра) (г/мл)
Молярная концентрация – отношение количества растворенного вещества к объему раствора
С(в-ва) = n(в-ва)/V(р-ра) (моль/л)
Коэффициент растворимости.
Коэффициент растворимости – характеристика раствора, означающая число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя. Измеряется в m (г) вещества на 100 г растворителя.
Терапевтическая и токсическая концентрация, их единицы измерения.
Терапевтическая концентрация – концентрация лекарственного вещества в крови, при которой возникает терапевтический эффект. Минимальная терапевтическая концентрация может соответствовать значению минимальной стационарной концентрации лекарственного вещества в крови
), создаваемой при проведении терапевтического мониторинга. (мкг/мл)
Токсическая концентрация – концентрация лекарственного вещества или его метаболита в крови, при которой возникают токсические эффекты от применения препарата. Минимальная токсическая концентрация может соответствовать значению максимальной стационарной концентрации лекарственного вещества или его метаболита в крови (Сssmax), создаваемого при проведении терапевтического мониторинга. (мкг/мл)
ПДК.
ПДК – максимальная концентрация вещества, не вызывающая токсического эффекта.
26 вопрос. Растворы электролитов. Изотопический коэффициент. Теория электролитической диссоциации.
Свойства растворов электролитов
В 1887 г. Вант-Гофф установил, что осмотическое давление, определенное экспериментально для солей, кислот и оснований превышает вычисленное по уравнению. Подобные отклонения наблюдались в сторону повышения для температуры кипения и в сторону понижения для температуры замерзания. Так, молярная масса NaCl, определенная криоскопией, оказалась равной 30, вместо 58,5, а Тзам почти вдвое превышает значение, вычисленное по закону Рауля. Не зная, чем объяснить эти отклонения, но, стремясь сделать уравнения пригодными для растворов электролитов, Вант-Гофф ввел в них поправочный множитель: i – изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов имеют вид:
Законы |
Неэлектролиты |
Электролиты |
Законы Рауля |
|
|
|
|
|
|
|
|
Закон Вант-Гоффа |
|
|
Здесь ![]()
Найденные Вант-Гоффом значения i для растворов солей, кислот, оснований имеют разные значения, зависящие от природы и концентрации растворителя, и изменяются от 1 до 4.
Увеличение π', Δt'к, Δt'з в растворах электролитов вызвано увеличением числа частиц в растворах, т.е. диссоциацией электролитов на ионы.
В 1887 году С. Аррениус положил это предположение в основу своей теории, объясняющей поведение солей, кислот, оснований в водных растворах.
Активность. Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, растворенного вещества и растворителя. Поэтому для учета этих взаимодействий в законы идеальных растворов было предложено ввести вместо концентраций компонентов активности. Активность а связана с концентрацией соотношением
![]() ,
,
где ![]() -
коэффициент активности, формально
учитывает взаимодействия частиц в
растворе, приводящие к отклонению от
свойств идеального раствора.
-
коэффициент активности, формально
учитывает взаимодействия частиц в
растворе, приводящие к отклонению от
свойств идеального раствора.
Коэффициент активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо свойство раствора и определяют коэффициент активности как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:
![]()
Итак, общие свойства растворов выражаются законами Рауля и Вант-Гоффа. В реальных растворах вместо концентрации используется активность
Теория электролитической диссоциации
В растворе электролита имеет место электролитическая диссоциация с образованием ионов. Эта идея была выдвинута С.Аррениусом.
Диссоциация – самопроизвольный распад электролита на ионы.
Положительно заряженные ионы называются катионами, отрицательно заряженные – анионами.
Распад электролитов на ионы объясняет отклонения от законов Рауля и Вант-Гоффа. Так, хлорид натрия переходит в раствор в виде ионов Na+ и Cl‾. При этом из одного моля NaCl получается не 6,02 .1023 частиц, а вдвое больше. Поэтому и понижение температуры замерзания в раствореNaCl должно быть вдвое больше, чем в растворе неэлектролита той же концентрации.
Точно так же в очень разбавленном растворе BaCl2, диссоциирующего по уравнению
BaCl2 = Ba2+ + 2Cl‾,
осмотическое давление оказывается в 3 раза больше чем, если бы хлорид бария находится в нем в виде молекул BaCl2.
Таким образом, особенности водных растворов электролитов, противоречащие с первого взгляда законам Рауля и Вант-Гоффа, были объяснены на основе этих же законов.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Она рассматривала ионы как независимые от растворителя частицы. Но ей противостояла гидратная теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков). Развитие этой идеи привело к объединению теорий Аррениуса и Менделеева.
Распадаться на ионы могут только те молекулы, в которых химическая связь имеет достаточно высокую степень ионности. Чтобы ионы молекулы электролита меньше притягивались друг к другу, растворитель должен обладать высоким значением относительной диэлектрической проницаемости (ε). Распаду электролита способствуют растворители с высоким значением ε. К ним относится вода (ε = 80,1), уксусная кислота (ε= 57), этиловый спирт (ε = 25).
Вещества могут распадаться на ионы и при расплавлении, когда энергии теплового движения оказывается достаточно для разрыва полярных связей.
Таким образом,
электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация протекает при растворении веществ с ионной структурой, в другом - при растворении веществ с полярной связью.
Когда кристалл соли с ионной связью попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу противоположными полюсами. Ионы испытывают тепловые колебания и толчки со стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом происходит растворение кристаллических веществ с ионной связью.
Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происходит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым движением молекул воды приводит к распаду полярной молекулы на ионы. Образующиеся в обоих случаях ионы гидратируются. При этом ион водорода Н+ (протон) прочно связывается с молекулой воды в ион гидроксония Н3О+. Схематически это можно представить уравнением:
Н2О + НCl = Н3О+ + Cl‾.
В результате этого процесса общая пара электронов молекулы НCl остается у атома хлора, который превращается в ион Cl‾, а протон, внедряясь в электронную оболочку кислорода молекулы воды, образует ион гидроксония Н3О+.
Протон водорода благодаря малым размерам и электростатическому полю высокой напряженности, а также отсутствию у него электронной оболочки, в водных растворах существует только в виде комплексов с молекулами воды Н3О+ окруженных другими молекулами воды.
Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В случае другого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
![]() ,
,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Значение понятия
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. Неэлектролиты в растворе недиссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы, образуя при этом несколько частиц на одну диссоциировавшую молекулу. Соответственно, и коллигативные свойства данного раствора (аддитивные величины) зависят от содержания в нём частиц (ионов) каждого типа из тех, которым принадлежат частицы, образовавшиеся в растворе в результате диссоциации исходной молекулы, — раствор представляется как бы смесью растворов каждого из типов частиц. Например, раствор хлорной извести содержит три типа частиц — катионы кальция,хлорид-анионы и гипохлорит-анионы. Итак, изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержитn ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α (при этом образуются N·α·n ионов), а общее количество частиц в растворе равно ((N — N·α) + N·α·n).
Изотонический же коэффициент равен отношению:
![]() .
.
Изотонический коэффициент в растворах сильных электролитов
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
![]() ,
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
Влияние внешних факторов
Очевидно, что взаимодействие ионов уменьшается с повышением температуры (вследствие возросшего теплового движения частичек), а также с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
Изотонический коэффициент был введён в последней четверти XIX века Я. Х. Вант-Гоффом. В 1901 году он первым получил Нобелевскую премию по химии — за свои заслуги в изучении растворов.
27вопрос..
Электролитическая диссоциация кислот,
оснований, солей.
Все
вещества по их поведению в растворах
принято условно делить на две группы:
а) электролиты и б) неэлектролиты.
Электролитами называют сложные вещества,
растворы и расплавы которых способны
проводить электрический ток. Неэлектролиты,
наоборот, электрический ток не
проводят.
К электролитам
относят большинство неорганических
кислот, щелочей и солей.
Электролиты — хлороводородная (соляная)
кислота НС1, хлорид натрия NaCl, гидроксид
калия КОН.
К
неэлектролитам относят многие
органические соединения, например
спирты, углеводы (сахара), а также
газообразные вещества и оксиды.
В химии диссоциацией принято называть
распад кристаллов и молекул на ионы,
который приводит к электрической
проводимости растворов. Следовательно,
причиной электрической проводимости
растворов и расплавов некоторых веществ
является образование носителей
электричества — свободных заряженных
частиц, называемых ионами.
Диссоциация происходит под действием
молекул растворителя (чаще воды) или
температуры. При этом химические связи
между частицами в кристаллической
решетке разрушаются.
Типичными видами связи для электролитов
являются ионная или ковалентная
полярная.
Таким образом, под электролитической
диссоциацией понимают процесс распада
электролитов на ионы под действием
молекул воды или при расплавлении.
Рассмотрим электролитическую диссоциацию
хлорида натрия (NaCl). При расплавлении
энергия, подводимая к кристаллам,
усиливает колебания ионов в узлах
кристаллической решетки, в результате
чего связи между ионами разрушаются и
появляются свободные ионы. Аналогичный
эффект достигается при растворении
хлорида натрия в воде. Только роль
разрушающего фактора выполняют молекулы
воды, которые как бы растягивают кристалл
на отдельные частицы. Но при этом ионы
оказываются окруженными («гидратированными»)
молекулами воды.
Уравнение диссоциации: ![]() Диссоциация веществ с ковалентной
полярной связью происходит несколько
сложнее, например диссоциация
хлороводорода в воде. Сначала происходит
взаимодействие молекул воды с молекулами
НС1, находящимися в узлах кристаллической
решетки, и их отщепление от нее, а затем
происходит «растягивание» полярной
молекулы НС1 на гидратированные ионы
Диссоциация веществ с ковалентной
полярной связью происходит несколько
сложнее, например диссоциация
хлороводорода в воде. Сначала происходит
взаимодействие молекул воды с молекулами
НС1, находящимися в узлах кристаллической
решетки, и их отщепление от нее, а затем
происходит «растягивание» полярной
молекулы НС1 на гидратированные ионы ![]() .
Уравнение электролитической диссоциации
хлороводорода выглядит так:
.
Уравнение электролитической диссоциации
хлороводорода выглядит так: ![]() .
В составе кислот, солей и оснований
(щелочей) можно выделить части,
определяющие их химические свойства.
У кислот это ионы водорода, у солей —
ионы металлов и кислотных остатков, у
щелочей — ионы гидроксогрупп.
а) Кислоты диссоциируют на катионы
водорода (упрощенно) и анионы кислотных
остатков:
.
В составе кислот, солей и оснований
(щелочей) можно выделить части,
определяющие их химические свойства.
У кислот это ионы водорода, у солей —
ионы металлов и кислотных остатков, у
щелочей — ионы гидроксогрупп.
а) Кислоты диссоциируют на катионы
водорода (упрощенно) и анионы кислотных
остатков:
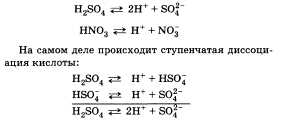

электролитическая диссоциация амфотерных электролитов. Существуют электролиты, которые могут диссоциировать и как кислоты, и как основания: H+ + RO- ⇄ ROH ⇄ R+ + OH- . Такие электролиты называются амфотерными. К ним относятся Al(OH)3, Zn(OH)2, Be(OH)2 , Sn(OH)2 , Pb(OH)2, TiO(OH)2 Pb(OH)2 и т.п. Для амфотерных электролитов следует рассматривать возможность диссоциации как по основному, так и по кислотному типу. Pb(OH)2 - амфотерный гидроксид: Pb(OH)2 ⇄ Н2PbО2 . В зависимости от условий, он может ступенчато диссоциировать как слабое основание (как было рассмотрено выше), или как слабая кислота Н2РbO2 : 1 стадия: H2PbО2 ⇄ H+ + HPbO2- Кдис.II= 1,5 ∙ 10-10 2 стадия: HPbO2 - ⇄ H+ + PbO2 2- Кдис.II= 2,0∙10-1
28. вопрос Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы.Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α).
Степень диссоциации - это отношение числа распавшихся на ионы молекул N' к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%,то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры.С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило,увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита -уксусной кислоты:
СН3СООН![]() СНзСОO-+ Н+
СНзСОO-+ Н+
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, - степень диссоциации кислоты возрастает. Наоборот,при упаривании раствора равновесие смещается в сторону образования молекул кислоты - степень диссоциации уменьшается.
![]()
Факторы, влияющие на степень электролитической диссоциации 1.Природа растворенного вещества. Под природой растворенного вещества в данном случае подразумевают природу химической связи в молекулах растворенных веществ. Чем более полярна химическая связь, тем выше степень диссоциации. Вещества с ионной химической связью относятся к сильным электролитам. Ковалентной полярной связью обладают, как правило, средние и слабые электролиты.
2.^ Природа растворителя. Чем более полярный растворитель, тем выше степень диссоциации растворенного вещества. Мерой полярности молекул растворителя может служить величина их дипольного момента. Но полярность растворителя в целом лучше характеризует диэлектрическая постоянная, т.е. величина, показывающая, во сколько раз сила взаимодействия двух зарядов в данной среде меньше, чем в вакууме. Если растворить хлороводород в воде и спирте, то в спирте степень диссоциации его меньше, поэтому кислотные свойства хлороводорода в спиртовом растворе будут выражены слабее.
3.^ Концентрация растворенного вещества. Увеличение содержания растворенного вещества в растворе приводит к уменьшению степени его диссоциации, так как молекула растворенного вещества будет взаимодействовать с меньшим количеством молекул растворителя. Степень диссоциации принимает максимальное значение =1 в бесконечно разбавленном растворе. 4.Температура. При повышении температуры степень диссоциации увеличивается. Это происходит потому, что с повышением температуры увеличивается амплитуда колебания атомов в молекуле и связь между ними ослабевает. Одновременно увеличивается скорость движения молекул растворителя и их кинетическая энергия, что также способствует распаду молекул растворенного вещества на ионы за счет большего числа их столкновений с молекулами растворителя.
5.^ Наличие в растворе одноименных ионов. Добавление к раствору слабой кислоты ее соли или более сильной кислоты приводит к уменьшению степени диссоциации. Причину этого уменьшения легко объяснить, применив принцип Ле Шателье к равновесию: HA H+ +A- . Увеличение концентрации любого из продуктов диссоциации приводит к сдвигу равновесия влево и увеличению концентрации непродиссоциировавших молекул кислоты. Это в свою очередь, означает уменьшение степени диссоциации. Изотонический коэффициент (коэффициент Вант-Гоффа) i – это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита. Обозначим: N – число растворенных молекул; - степень диссоциации; n – число ионов, на которые распадается одна молекула электролита. Тогда: N – число молекул, распавшихся на ионы; Nn – число образовавшихся ионов; N(1 - ) –число молекул не распавшихся на ионы; Nn + N(1 - ) - общее число частиц в растворе. I = Nn +N(1 - / N = n + (1 - = 1 + (n – 1). Отсюда: (i –1) /(n – 1). (5.6) Из-за диссоциации общее число частиц в растворе электролита больше, чем в растворе неэлектролита той же концентрации, поэтому осмотическое давление, повышение температуры кипения и понижение температуры замерзания для раствора электролита будут выше, чем для раствора неэлектролита той же концентрации (все эти величины зависят только от числа частиц в растворе).
-
Неэлектролиты i=1
Электролиты i
Р =Р0N2
iP0N2
tкрист= Ккcm
Dtкип= Кэcm
tкип= Кэcm
tкип=iКэcm
π= cMRT
π=icMRT
i =
/tкрист/tкрист =
tкип/tкип =
π/π.
Величины
в числителе определяют экспериментально,
в знаменателе вычисляют по соответствующим
формулам:
![]() ^ Константа
электролитической диссоциации.
В
растворах слабых электролитов процесс
диссоциации протекает обратимо и
устанавливается равновесие, которое
можно охарактеризовать константой
равновесия К:
КА
К+ +
А-
ККА =
К+-,
где
+,
-
и
- концентрации в растворе ионов К+,
А- и
непродиссоциировавших молекул КА ( в
моль/л).
Для данного электролита
значение К постоянно при определенной
температуре и в отличие от
не зависит от концентрации.
Установим
связь между К,
и сМ для
бинарного электролита (т.е. распадающегося
на два иона).
Концентрация ионов К+ и
А- в
растворе +-=
сМ,
концентрация непродиссоциировавших
молекул в КА растворе сМ,,
откуда
К = 2сМ2/(1
- )сМ или
К = 2сМ/(1
- ).
Последнее
уравнение выражает закон разбавления
Оствальда.
^ Константа
электролитической диссоциации.
В
растворах слабых электролитов процесс
диссоциации протекает обратимо и
устанавливается равновесие, которое
можно охарактеризовать константой
равновесия К:
КА
К+ +
А-
ККА =
К+-,
где
+,
-
и
- концентрации в растворе ионов К+,
А- и
непродиссоциировавших молекул КА ( в
моль/л).
Для данного электролита
значение К постоянно при определенной
температуре и в отличие от
не зависит от концентрации.
Установим
связь между К,
и сМ для
бинарного электролита (т.е. распадающегося
на два иона).
Концентрация ионов К+ и
А- в
растворе +-=
сМ,
концентрация непродиссоциировавших
молекул в КА растворе сМ,,
откуда
К = 2сМ2/(1
- )сМ или
К = 2сМ/(1
- ).
Последнее
уравнение выражает закон разбавления
Оствальда.
29 вопрос..
Константа диссоциации —
вид константы
равновесия,
которая показывает склонность большого
объекта диссоциировать (разделяться)
обратимым образом на маленькие объекты,
как например когда комплекс распадается
на составляющие молекулы,
или когда соль разделяется
в водном растворе на ионы.
Константа диссоциации обычно
обозначается ![]() иобратна константе
ассоциации.
В случае с солями, константу диссоциации
иногда называют константой
ионизации.
иобратна константе
ассоциации.
В случае с солями, константу диссоциации
иногда называют константой
ионизации.
В общей реакции
![]()
где комплекс ![]() разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
