
- •1 Вопрос классификация неорганических веществ
- •2 Вопрос Основные понятия химии
- •3 Вопрос Закон сохранения массы вещества. Закон постоянства состава. Закон Авогадро. Молярный объем. Число Авогрдо.
- •4 Вопрос Закон эквивалентов. Определение молярных массэквивалентов солей, оснований, кистот, элементов
- •6 Вопрос Основные сведения о строении атомов. Протон, нейтрон,электрон. Квантовые числа. Максимальное число электронов на энергетических уровнях и полдуровнях.
- •8 Вопрос Периодический закон Менделеева. Структура периодической системы.
- •9 Вопрос Определение свойств элементов по строению электронных оболочек атомов.
- •10 Вопрос Периодическое изменение свойств химических элементов (атомные радиусы, степень окисления, вост и окисл свойства эелементов и простых веществ, свойства оксидов и гидроксидов )
- •11 Вопрос. Энергия ионизации. Сродство электрону. Электроотрицательность.
- •12 Вопрос. Химическая связь. Металлическая связь. Ионная связь
- •13 Вопрос Ковалентная связь.
- •14 Вопрос Водородная связь. Донорно-акцепторная связь.
- •15 Вопрос Межмолекулярное взаимодействие.
- •16 Вопрос. Скорость хим. Реакций. Гомогенные и гетерогенные системы.
- •17 Вопрос. Зависимость скорости гомогенных реакций от концентрации реагирующих веществ. Закон действия масс.
- •18 Вопрос. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •19 Вопрос. Гомогенные и гетерогенный катализ.
- •20 Вопрос. Обратимые реакции. Химическое равновесие. Константа химического равновесия.
- •21 Вопрос. Смещение химического равновесия. Принцип Ле Шателье.
- •22 Вопрос. Энергетика хим. Реакций. Внутренняя энергия. Энтальпия. Энтропия. Термохим уравнения. Закон Гесса. Следствие из закона Гесса.
- •1 Следствие
- •2 Следствие
- •Лавуазье-Лапласа: тепловой эффект образования химических соединений равен, но обратен по знаку тепловому эффекту его разложения.
- •Гесса: тепловой эффект реакции при постоянном давлении или объеме зависит только от начального и конечного состояния системы и не зависит от пути перехода.
- •23 Вопрос. Энергия Гиббса. Направленность хим. Процессов. Анализ уравнения Гиббса.
- •24 Вопрос. Растворы. Растворимость веществ. Энергетика растворения. Общие свойства растворов(осмос, понижение и повышение температуры замерзания и кипения растворов)
- •25 Вопрос. Состав растворов. Способы выражения состава раствор (безразмерные, концентрации)
- •30Вопрос . Ионные уравнения реакций
- •32 Вопрос.Диссоциация воды
- •33 Вопрос. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
- •Вопрос . Степень гидролиза
- •36Вопрос. Окисли́тельно-восстанови́тельные
- •41 Вопрос . Электрохимическая коррозия
- •1) Гомогенный механизм электрохимической коррозии:
- •2) Гетерогенный механизм электрохимической коррозии:
- •44 Вопрос . Вода в природе
- •46 Вопрос.
- •49 Вопрос .
- •50Вопрос .
- •51 Вопрос .
- •53. Неорганические вяжущие вещества
24 Вопрос. Растворы. Растворимость веществ. Энергетика растворения. Общие свойства растворов(осмос, понижение и повышение температуры замерзания и кипения растворов)
Истинные растворы
Растворы бывают газообразные (газовые смеси), жидкие и твердые. Газообразным раствором является воздух. Морская вода – смесь солей в воде – жидкий раствор. Твердые растворы – металлические сплавы.
Наибольшее практическое значение имеют жидкие растворы.
Растворы состоят из растворителя и растворенного вещества (веществ). Основными параметром состояния раствора является концентрация.
Способы выражения концентрации растворов.
Концентрация раствора – это масса или количество растворенного вещества в определенном количестве, массе или объеме раствора или растворителя.
Наиболее распространены следующие способы выражения концентрации растворов.
При постоянной массе раствора
а) Массовая доля (масс.%) – это масса растворенного вещества, содержащаяся в 100 единицах массы раствора.
б) Молярная доля – Xi – число молей растворенного вещества в 100 молях раствора.
![]()
При постоянной массе растворителя
а) Моляльная концентрация Сm – количество молей растворенного вещества, содержащихся в 1 кг растворителя [моль/кг].
При постоянном объеме раствора
а) Молярная концентрация СМ– количество молей растворенного вещества, содержащаяся в 1 литре раствора [моль/л].
б) Молярная концентрация эквивалентов (нормальная концентрация) СН – количество молей эквивалентов вещества, содержащаяся в 1 литре раствора [моль/л].
В) Титр раствора Т – масса растворенного вещества, содержащаяся в 1 миллилитре раствора [г/мл].
Молярная, массовая доли могут быть выражены в % (умножением на 100); промилле, 0/00 (умножением на 1000); в частях на миллион, ppm(умножением на 106); в частях на миллиард, ppb (умножением на 109).
Пользуясь растворами, концентрация которых выражена молярной концентрацией эквивалентов, можно рассчитать объемные отношения реагирующих веществ, так как вещества реагируют в эквивалентных количествах, то
объемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов: V1/V2 = CН2/СН1
Теории образования растворов
В создании современной физико-химической теории растворов большую роль сыграли работы русских ученых Д.И. Менделеева, И.А. Каблукова, Д.П. Коновалова и др.
В конце 19 в. все растворы считались физическими смесями веществ, в которых отсутствуют взаимодействия между растворенным веществом и растворителем. Химические явления при растворении были отмечены Д.И. Менделеевым. Взаимодействие молекул растворителя с растворенным веществом называется сольватацией, а образующиеся соединения – сольватами. Если растворителем является вода, то процесс называется гидратацией, а образующиеся соединения – гидратами. Образованием гидратов можно объяснить выделение теплоты при растворении. Образованием гидратов можно объяснить скачкообразное изменение свойств растворов при непрерывном изменении содержания растворенного вещества, что соответствует изменению состава продукта взаимодействия растворителя с растворенным веществом при увеличении содержания вещества в растворе.
Явления, наблюдаемые при образовании растворов
Изменение объема
При растворении объем раствора всегда меньше суммы объемов растворителей и растворяемого вещества.
Так, при смешении 1 л этилового спирта с 1 л воды объем образующегося раствора оказывается равным не 2 л, а 1,93 (25°С). Уменьшение объема обусловлено в основном образованием водородных связей между гидроксильными группами молекул спирта и воды, а также разрушениемльдоподобной структуры воды.
Изменение окраски
Связано с образованием химических соединений с водой. При выпаривании из растворов выделяются кристаллы, содержащие воду. Вещества называются кристаллогидратами, а вода, входящая в их состав – кристаллизационной.
CuSO4 +
4H2O ![]() [Cu(OH2)4]2+SO4
[Cu(OH2)4]2+SO4
Белый голубой р-р.
Кристаллогидрат сульфата меди – CuSO4·5H2O
Изменение энтальпии и энтропии
Растворение – совокупность физических и химических явлений, при которых происходят процессы:
а) разрушение связей в растворяющихся газах, жидкостях или твердых телах - требуется затраты энергии, ΔН1 > 0.
б) образование сольватов (или гидратов) сопровождается выделением энергии, ΔН2 < 0.
в) перемешивание раствора, связанное с диффузией сольватов (гидратов) требует затраты энергии, ΔН3 > 0.
ΔНр-рения = ΔН1 + ΔН2 + ΔН3 .
Так как тепловой эффект растворения равен алгебраической сумме отдельных процессов и может быть как положительным так и отрицательным.
Если растворяются газы или жидкости, то ΔН1 невелико и ΔН < 0 – экзотермический процесс.
Если растворяются кристаллические вещества, дробление требует затрат и энергии и ΔН > 0 – эндотермический процесс.
Растворение идет самопроизвольно (ΔG < 0) до насыщения раствора. При этом тепловой эффект процесса растворения (ΔН) и изменение энтропии при растворении ( ΔS) могут быть и положительными и отрицательными.
Растворение газов идет с выделением теплоты (ΔН < 0) и с убылью энтропии (ΔS < 0). Согласно уравнению ΔG = ΔН - TΔS, самопроизвольному процессу растворения газа в воде способствуют низкие температуры.
Растворение кристаллических веществ часто идет с поглощением теплоты (ΔН > 0) и обычно сопровождается ростом энтропии (ΔS > 0). Согласно уравнению Гиббса, самопроизвольному процессу растворения кристаллических веществ в воде способствуют высокие температуры. При низких температурах, возможно, что величина ТΔS не достигнет значения ΔН и энергия Гиббса будет положительна (ΔG > 0).
Насыщенные и пересыщенные растворы При растворении твердого вещества в воде сначала образуется ненасыщенный раствор, в котором возможно растворение следующих порций до тех пор, пока вещество не перестанет переходить в раствор и часть его не останется в виде осадка на дне стакана. При этом образуется насыщенный раствор: между веществом в насыщенном растворе и тем же веществом в осадке устанавливается состояниегетерогенного равновесия. KBr(т) Частицы растворённого вещества переходят из осадка в раствор и обратно; при этом состав насыщенного раствора остается постоянным при T=const. Иногда приготовление раствора в особых условиях (осторожное охлаждение горячего ненасыщенного раствора) ведет не к насыщенному раствору (с осадком), а к пересыщенному раствору. Такой раствор обычно неустойчив - при введении "затравки" (кристаллика вещества) избыточное количество растворяемого вещества выпадает в осадок, и раствор становится насыщенным. Растворимость веществ Содержание вещества в насыщенном растворе при T=constколичественно характеризует растворимость этого вещества. Обычно растворимость выражается массой растворенного вещества, приходящейся на 100 г воды. Эта величина - коэффициент растворимости(например, 65,2 г KBr / 100 г H2O при 20 °С). Следовательно, если 70 г твердого бромида калия внести в 100 г воды при 20 °С, то 65,2 г соли перейдет в раствор (который будет насыщенным), а 4,8 г твердого бромида калия (избыток) останется на дне стакана. Содержание растворённого вещества в насыщенном растворе равно, в ненасыщенном растворе меньше и пересыщенном больше его растворимости при данной температуре. Так, раствор, приготовленный при 20 °С из 100 г воды и сульфата натрия Na2SO4 (растворимость 19,2 г / 100 г H2O), при содержании 12,3 г соли - ненасыщенный, 19,2 г соли - насыщенный, 20,1 г соли - пересыщенный. Растворимость твердых веществ обычно увеличивается с ростом температуры (KBr, NaCl) и лишь для некоторых веществ (CaSO4, Li2CO3) наблюдается обратное: Растворимость, г / 100 г H2O
Растворимость газов при повышении температуры падает, а при повышении давления растет, например, при давлении 1 атм растворимость аммиака составляет 52,6 (20 °С) и 15,4 г / 100 г H2O (80 °С), а при 20 °С и 9 атм она равна 93,5 г / 100 г H2O. Растворимые и нерастворимые вещества В соответствии со значениями растворимости различают вещества а) хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой воды (например KBr, при 20 °С растворимость 65,2 г / 100 г H2O; это 4,6М раствор); б) малорастворимые, масса которых в насыщенном растворе значительно меньше массы воды (например CaSO4, при 20 °С растворимость 0,206 г / 100 г H2O; это 0,015М раствор); в) практически нерастворимые, масса которых в насыщенном растворе пренебрежимо мала по сравнению с массой растворителя(например AgCl, при 20 °С растворимость 0,00019 г / 100 г H2O; это 0,0000134М раствор). Качественная характеристика растворимости различных веществ при комнатной температуре приведена в таблице растворимости, количественнаяхарактеристика - в справочных таблицах по значениям растворимости:
Разбавленные и концентрированные растворы Растворы, которые содержат малое количество растворенного вещества, часто называют разбавленными растворами, а растворы с высоким содержанием растворенного вещества - концентрированными. Так, 1%-ный и 0,1М растворы бромида калия KBr - это разбавленные растворы, а 32%-ный и 4,3М растворы KBr - это концентрированные растворы. Очевидно, что концентрированные растворы могут образовать только хорошо растворимые вещества, а разбавленные растворы - вещества с любой растворимостью. В лабораторной практике часто приходится готовить разбавленный раствор вещества B с массовой долей wB′ и массой mB′ из концентрированного раствора того же вещества (с характеристиками wB″ и массой mB″). Масса растворенного вещества при разбавлении не изменяется: mB=wB′ ·m(р)′ =wB″ ·m(р)″ Масса добавленной воды равна m(добавленной H2O)= m(р)′ -m(р)″ |
Энергетика растворения
Процесс растворения твердого вещества в воде сопровождается разрушением кристаллической решетки (затрата энергии в форме теплоты, -Qкр) игидратацией - образованием гидратов B · nH2O, то есть соединений переменного состава между частицами растворенного вещества и молекулами воды (выделение теплоты, +Qгидр).
В результате общий тепловой эффект растворения равен Q(р) = -Qкр + Qгидр
Если тепловой эффект растворения положительный (Q(р) больше 0), то после растворения вещества раствор становится теплее (например, это происходит в случае приготовления раствора AlCl3), если же тепловой эффект отрицательный (Q(р) меньше 0), то раствор становится холоднее (иногда температура может опуститься ниже 0 °С, например для NaNO3 или NH4NO3).
В тех редких случаях, когда Q(р) = 0, температура раствора остается постоянной (например, для NaCl).
Переход в раствор жидких и газообразных веществ также сопровождается гидратацией их молекул и положительным тепловым эффектом. Поэтому в соответствии с принципом Ле-Шателье повышение температуры ведет к уменьшению растворимости газов в воде.
Таким образом, растворение - это физико-химический процесс разрушения связей в исходных веществах и образования новых связей в гидратах. Это положение является основным содержанием химической теории растворов Д.И. Менделеева.
Общие свойства растворов Качественный и количественный состав растворов Раствор - это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Состав растворов обычно передаётся содержанием в них растворённого вещества в виде массовой доли или молярной концентрации. Жидкие растворы (в дальнейшем будем называть их просто "растворами") состоят из жидкого растворителя (чаще всего воды) и растворенного вещества, которое до смешения с растворителем могло быть твердым (например KBr), жидким (например H2SO4) или газообразным (например CO2). Состояние веществ в водном растворе обозначается (р), например KBr(р). Состав растворов обычно передается содержанием в нем растворенного вещества в виде массовой доли или молярной концентрации. Массовая доля и молярная концентрация растворённого вещества Массовая доля wВ растворенного вещества В - это отношение его массы mB к массе раствора m(р): wВ = mB / m(р), где m(р) = mB + m(Н2О). Единица массовой доли вещества в растворе - доля от единицы или от 100%. Например, если в 100 г раствора находится 1 г KBr, то w(KBr) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr). Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды. Плотность воды при комнатной температуре принимают равной 1 г/мл, поэтому удобнее отмерять 99 мл воды и добавить 1 г соли. Молярная концентрация сВ растворённого вещества В - это отношение количества этого вещества nВ к объему раствора V(р): сВ = nВ / V(р). Единица молярной концентрации вещества в растворе: моль/л. Например, если в 1 л раствора содержится 1 моль KBr, то с(KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означают деци-, санти- и миллимолярный раствор. Для приготовления 1 л 1М раствора KBr необходимо взять навеску соли с количеством вещества 1 моль (то есть 119 г), растворить ее в воде объемом, например, 0,8 л (то есть обязательно меньше 1 л) и затем довести объем раствора до 1 л добавлением воды. Объем раствора V(р) при данной температуре связан с массой раствора m(р) и его плотностью (ρ) следующим образом: m(р) = ρ · V(р). Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л). |
ОСМОС (от
греч. ![]() -толчок, давление),
самопроизвольный перенос в-ва
через полупроницаемую
мембрану,
разделяющую два р-ра разл.концентрации или
чистый р-ритель и р-р. Наиб. часто
происходит переход р-рителя
через полупроницаемую
мембрану,
не пропускающую растворенное в-во.
Самопроизвольный массоперенос
возникает в результате того, что
хим. потенциал р-рителя уменьшается
при увеличенииконцентрации растворенного
в-ва.
-толчок, давление),
самопроизвольный перенос в-ва
через полупроницаемую
мембрану,
разделяющую два р-ра разл.концентрации или
чистый р-ритель и р-р. Наиб. часто
происходит переход р-рителя
через полупроницаемую
мембрану,
не пропускающую растворенное в-во.
Самопроизвольный массоперенос
возникает в результате того, что
хим. потенциал р-рителя уменьшается
при увеличенииконцентрации растворенного
в-ва.
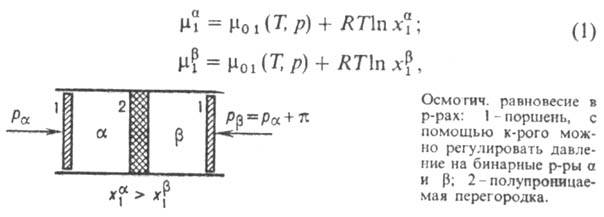
Рассмотрим
два объема ![]() и
и ![]() бинарного
р-ра (см. рис.), разделенных полупроницаемой
перегородкой, пропускающей молекулы р-рителя
(компонент 1) и не пропускающей молекулы растворенного
в-ва (компонент 2). Если т-ра T и давление р
по обе стороны перегородки одинаковы
(Т
бинарного
р-ра (см. рис.), разделенных полупроницаемой
перегородкой, пропускающей молекулы р-рителя
(компонент 1) и не пропускающей молекулы растворенного
в-ва (компонент 2). Если т-ра T и давление р
по обе стороны перегородки одинаковы
(Т![]() =
Т
=
Т![]() ,
, ![]() ),
а молярные доли различны (
),
а молярные доли различны (![]() ),
то
),
то ![]() (Т,
р,
(Т,
р, ![]() )
>
)
>![]() (Т,
р,
(Т,
р,![]() ).
Для идеальных или сильно разбавленных
реальных р-ров, где
).
Для идеальных или сильно разбавленных
реальных р-ров, где![]() -хим.
потенциал чистого р-рителя, R-газовая
постоянная. При
-хим.
потенциал чистого р-рителя, R-газовая
постоянная. При ![]() система
термодинамически неравновесна и,
следовательно, имеет место переход
компонента 1 из объема
система
термодинамически неравновесна и,
следовательно, имеет место переход
компонента 1 из объема![]() в
объем
в
объем ![]() до
тех пор, пока его молярные доли в обоих
объемах не станут одинаковыми. Для того
чтобы предотвратить массоперенос и
выравнивание концентраций и
сохранить первонач. состав обоих р-ров,
необходимо выравнить хим. потенциалы
компонента 1 по обе стороны перегородки
изменением внеш. условий (т-ры, давления,
внеш. электрич. поля, если речь идет о
р-рах электролитов).
В изотермич. условиях для сохранения
состава фаз необходимо изменить давление на
один из р-ров. Из термодинамики известно,
что
до
тех пор, пока его молярные доли в обоих
объемах не станут одинаковыми. Для того
чтобы предотвратить массоперенос и
выравнивание концентраций и
сохранить первонач. состав обоих р-ров,
необходимо выравнить хим. потенциалы
компонента 1 по обе стороны перегородки
изменением внеш. условий (т-ры, давления,
внеш. электрич. поля, если речь идет о
р-рах электролитов).
В изотермич. условиях для сохранения
состава фаз необходимо изменить давление на
один из р-ров. Из термодинамики известно,
что
![]()
где ![]() -парциальный
молярный объем р-рителя. Для идеальных
или предельно разбавленных реальных
р-ров
-парциальный
молярный объем р-рителя. Для идеальных
или предельно разбавленных реальных
р-ров ![]() ,
где
,
где ![]() -молярный
объем чистого р-рителя. Знак производной
положительный и при увеличении давления,
приложенного к р-ру
-молярный
объем чистого р-рителя. Знак производной
положительный и при увеличении давления,
приложенного к р-ру ![]() ,
хим. потенциал р-рителя будет возрастать.
Дополнит. давление
,
хим. потенциал р-рителя будет возрастать.
Дополнит. давление ![]() ,
к-рое надо приложить к р-ру
,
к-рое надо приложить к р-ру ![]() для
того, чтобы предотвратить поступление
в него р-рителя черезполупроницаемую
мембрану из
р-ра
для
того, чтобы предотвратить поступление
в него р-рителя черезполупроницаемую
мембрану из
р-ра ![]() ,
наз. осмотич. давлением.
При давлении
,
наз. осмотич. давлением.
При давлении ![]() система
находится в термодинамически равновесном
состоянии:
система
находится в термодинамически равновесном
состоянии:
![]()
Если ![]() , равновесие нарушается
и имеет место перенос р-рителя из более
концентрир. р-ра в менее концентрированный.
Это явление получило назв. обратного
осмоса;
оно находит широкое практич. применение
в мембранных
процессах разделения в-в.
, равновесие нарушается
и имеет место перенос р-рителя из более
концентрир. р-ра в менее концентрированный.
Это явление получило назв. обратного
осмоса;
оно находит широкое практич. применение
в мембранных
процессах разделения в-в.
Для идеальных р-ров зависимость осмотич. давления от состава выражается ур-нием:
![]()
где ![]() -парциальные давления р-рителя
в фазах
-парциальные давления р-рителя
в фазах ![]() и
и ![]() .
Если фаза
.
Если фаза ![]() представляет
собой чистый р-ритель, т.е.
представляет
собой чистый р-ритель, т.е. ![]() ,
то
,
то ![]() ;
ур-ние принимает вид, известный как
ур-ние Ван Лаара:
;
ур-ние принимает вид, известный как
ур-ние Ван Лаара:
![]()
Из него следует, что осмотич. давление р-ра пропорционально ln x1. Этой же величине пропорциональны понижение т-ры замерзания и повышение т-ры кипения идеальных р-ров (см. Рауля закон), что свидетельствует о связи этих явлений с осмосом.
Если концентрация растворенного в-ва мила, зависимость осмотич. давления от его молярной концентрации с2 выражается ур-нием Вант-Гоффа:
![]()
Это ур-ние обычно используют для расчета осмотич. давления бинарных р-ров недиссоциирующих в-в. Однако лучшее совпадение расчетных значений с экспериментальными в широкой концентрац. области дает ур-ние Ван Лаара (см. табл.). О методах и технике измерения осмотич.давления
Понижение температуры замерзания и повышение температуры кипения растворов
Прямым следствием понижения давления пара над раствором является изменение температуры замерза–ния ?Тз и температуры кипения растворов ?Тк по срав–нению со значениями этих величин для чистого рас–творителя. Соотношения между этими величинами также вытекают из второго начала термодинамики.
Температурой кипения жидкости является температу–ра, при которой давление ее паров становится равным внешнему давлению (так, при 101,3 кПа температура кипения воды равна 100 °С). Температурой замерзания (кристаллизации) жидкости является температура, при которой давление пара над жидкостью равно давлению пара над твердой фазой. Если обозначить температуры замерзания и кипения раствора Т3 и Тк , а эти же вели–чины для растворителя Т°3 и Т°к , то получим:
?Тк = Тк – Т°к > 0,
?Т3 = Т°3 – Т3 > 0.
Эффекты повышения температуры кипения и пониже–ния температуры замерзания растворов качественно могут быть объяснены с помощью принципа Ле Шателье.
Действительно, если в равновесную систему «жид–кость – пар» (например, Н2О(ж) – Н2О(г)), ввести раство–римое нелетучее вещество, то давление пара раствори–теля над раствором уменьшится. Чтобы компенсировать понижение давления пара и достигнуть прежнего равно–весного состояния, раствор нужно нагреть до более вы–сокой температуры (больше 373°К), так как процесс эн–дотермический.
Пусть имеется равновесная система «твердая фаза – жидкость», например Н2О(т) > Н2О(ж), при 273°К. Ес–ли растворить в жидкой фазе некоторое количество не– летучего вещества (нерастворимого в твердой фа–зе), то концентрация молекул воды в жидкой фазе уменьшится. В соответствии с принципом Ле Шателье начнет идти процесс, увеличивающий количество воды в жидкой фазе, – плавление льда. Для установления но–вого равновесия раствор необходимо охладить, т. е. по–низить температуру, так как процесс экзотермический.
По закону Рауля для разбавленных растворов пони–жение давления пара пропорционально концентрации раствора. Следовательно, повышение температуры ки–пения и понижение температуры замерзания таких ра–створов должно возрастать с увеличением их концент–рации.
Изучая замерзание и кипение растворов, Рауль уста–новил: повышение температуры кипения ?Тк и пони–жение температуры замерзания ?Т3 разбавленных растворов неэлектролитов прямо пропорциональ–но молярной концентрации раствора:
?Тк =Кэb(x),
?Т3 = Кз b(x),
где b(X) – молярная концентрация, моль/кг;
Кз и Кэ – коэффициенты пропорциональности,
кг ? К ? моль-1 , которые называются соответственно эбулиометрической и криометрической константами. Физический смысл констант Кэ и Кз становится ясен, если принять b(X) = 1. Тогда Кэ = ?Тк , а Кз = ?Тз . Иначе го–воря, эбулиометрическая константа численно равна по–вышению температуры кипения одномолярного раст–вора, а константа криометрическая – понижению температуры замерзания одномолярного раствора.
Эбулиометрические и криометрические константы зависят только от природы растворителя и не зависят от природы растворенного вещества (идеальные раст–воры).
