
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •25.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
Реакции третьего порядка
А+В+С® продукты

 a=b=c
и
C0A=C0B=C0C=C
a=b=c
и
C0A=C0B=C0C=C
Период полураспада для реакций III порядка равен:
![]()
Вероятность столкновения четырёх молекул практически равна нулю.

В практике бывают случаи, когда концентрации одного или нескольких компонентов в системе остаются постоянными или приблизительно постоянными во времени. Тогда все постоянные множители кинетического уравнения объединяют в константу скорости реакции и о порядке ее судят по сумме показателей степеней при изменяющихся концентрациях и называют её псевдопорядком реакции.
Таковы гетерогенные реакции, реакции в буферных системах и реакции, когда один из нескольких компонентов находятся в избытке, (гидролиз сложных эфиров).
24. Скорость химической реакции в однородной среде. Константа скорости.
Гомогенной называется система, состоящая из одной фазы. Например, любая газовая смесь, водные растворы солей в воде, реакции в расплавах. Гомогенные реакции обычно протекают (идут) во всем объеме системы. Например, помутнение раствора, вызываемое появлением серы, происходит во всем объеме. H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2 + S ¯
Скорость гомогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
На практике обычно приходится встречаться с реакциями, протекающими в статистических условиях или в потоке. Реакции в статистических условиях протекают при V=const.
![]() Средняя
скорость
гомогенной реакции, протекающей в
статистических условиях, определяется
как изменение концентрации веществ в
единицу времени:
Средняя
скорость
гомогенной реакции, протекающей в
статистических условиях, определяется
как изменение концентрации веществ в
единицу времени:
Чаще всего концентрацию выражают в моль/л. Средняя скорость реакции не одинакова в интервале времени t, т.к. концентрации веществ со временем также изменяются.
Кинетические зависимости для реагентов и продуктов реакции имеют вид:
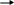 О
О дносторонняя
реакция в статистических условиях: A
B
дносторонняя
реакция в статистических условиях: A
B
Чтобы выражение для скорости было всегда положительным, необходимо
в правой части уравнения выбирать знак «+» или «-» в зависимости от того, по изменению какой концентрации (реагента или продукта) выполняется расчет. Поэтому в химической кинетике принято говорить не о скорости химической реакции вообще, а о скорости по некоторому компоненту. В кинетике чаще используется понятие истинной (мгновенной) скорости реакции, которая определяется пределом, к которому стремится выражение DС/Dt при Dt ® 0, т.е. изменение концентрации вещества, отнесённое к бесконечно малому промежутку времени.
![]() В
кинетике чаще используется понятие
истинной
(мгновенной)
скорости
реакции
В
кинетике чаще используется понятие
истинной
(мгновенной)
скорости
реакции
![]() определяется
пределом, к которому стремится выражение
Dс/Dt
при Dt®0,
т.е. изменение концентрации вещества,
отнесению к бесконечно малому промежутку
времени.
определяется
пределом, к которому стремится выражение
Dс/Dt
при Dt®0,
т.е. изменение концентрации вещества,
отнесению к бесконечно малому промежутку
времени.
В
каждый момент времени скорость реакции
равна тангенсу угла наклона кривой с
= f(t)
в данной точке. Константа
скорости.
Если зависимость скорости реакции от
концентрации реагирующих веществ
записывается в виде(1)
![]()
то величины ni (i = I, 2, ..,, I) принято называть порядком реакции по веществу Аi.
Сумму порядков реакции по всем реагирующим веществам называют порядком реакции. Множитель и в кинетическом уравнении (1), показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных единице, называется константой скорости химического процесса. Наряду со скоростью константа скорости химического процесса является основной величиной в химической кинетике.
Степенная зависимость скорости реакции от концентраций реагирующих веществ (1) практически всегда выполняется для скорости отдельных стадий химического процесса. При этом как порядок по отдельному компоненту, так и суммарный порядок реакции являются целыми положительными числами. Для отдельной стадии порядок реакции никогда не превышает трех. Поэтому особо важное значение в химической кинетике имеют реакции первого, второго и третьего порядка.
Константы скорости реакций различного порядка имеют разную размерность. Поскольку размерность скорости реакции независимо от кинетического уравнении этой реакции есть [С] [t]-1, то из (1) следует, что размерность константы скорости для реакции первого порядка [t]-1, второго порядка [С]-1 [t]-1, третьего порядка [С]-2 [t]-2.
В соответствии с этим единицами измерения констант скорости являются:
для реакции 1 порядка: с-1 ; для реакции 2 порядка: м3/молекула · с (м3 · с-1) или М-1 · с-1 [л/(моль · с)] ; для реакции 3 порядка: м6/молекула2 · с (м6 · с-1) или М-2 · с-1 [л2/(моль · с)]
При использовании молярных единиц для выражения концентрации при расчетах в системе единиц СИ следует помнить, что это эквивалентно использованию единиц кмоль/м3, и поэтому все остальные величины, относимые к определенному количеству вещества (универсальная газовая постоянная, число Авогадро), должны также браться в расчете на 1 киломоль.
Следует подчеркнуть, что константы скорости реакций разных порядков являются разными физическими величинами и сопоставление их абсолютных значений лишено какого бы то ни было смысла. При переходе от одной единицы измерения концентрации к другой константа скорости реакции первого порядка не изменяется, константа скорости реакции второго порядка изменяется в 6,02 · 1026 раз, а константа скорости реакции третьего порядка — в 3,6 · 1053 раз.
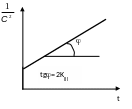
Константа
скорости химической реакции, как правило,
резко растет с повышением температуры.
Зависимость константы скорости реакции
от температуры в большом числе случаев
может быть описана уравнением Аррениуса(2)
![]()
где Т — абсолютная температура; k0 и Е — постоянные параметры.
Поскольку
концентрация реагирующих веществ
практически не зависит от температуры,
то такое же соотношение получается и
для скорости процесса (3)
![]()
Таким образом, чем больше Е, тем быстрее растет скорость реакции с температурой. Для простых реакций параметр Е показывает, какой минимальной энергией (в расчете на один моль) должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. Частицы, энергия которых больше или равна Е, называются активными, а параметр Е в связи с этим называют энергией активации.
Для
сложных реакций, состоящих из нескольких
стадий, параметр Е в уравнении (2), как
правило, не имеет такого простого
физического смысла и является некоторой
функцией энергии активации отдельных
стадий. Тем не менее и в этом случае
параметр. Е принято называть энергией
активации, хотя правильнее было бы
называть его эффективной или эмпирической
энергией активации. Параметр k0 называется
предэкспоненциальным множителем.
Параметры Е и k0 могут быть определены
из зависимости константы скорости
реакции от температуры с помощью
уравнения (2), записанного в виде (5)
![]()
