
- •34. Водород. Атом и молекула водорода, изотопы водорода. Гидриды металлов и неметаллов. Водород как окислитель и восстановитель. Получение водорода в лаборатории и в промышленности.
- •36. Вода. Фазовая диаграмма воды. Физические и химические свойства. Автопротолиз. Горение водорода в кислороде. Топливные элементы.
- •37. Пероксид водорода. Окислительно-восстановительные свойства, получение и применение пероксида водорода. Пероксиды металлов.
- •39. Галогеноводороды. Физические и химические свойства (температуры кипения, сила кислот и восстановительная способность). Особенности фтороводорода. Биологическая роль галогенов.
- •40.Кислородные кислоты галогенов. Кислотно-основные и окислительные свойства оксокислот хлора. Устойчивость кислородных кислот хлора и их солей, применение солей оксокислот хлора.
- •41. Сера. Строение молекул и свойства простого вещества. Сероводород и сульфиды. Полисульфиды. Восстановительные свойства сероводорода и сульфидов, растворимость сульфидов металлов.
- •42. Оксиды серы. Получение и свойства оксидов серы (IV) и (VI). Сернистая и серная кислота, сульфиты и сульфаты. Окислительно-восстановительные свойства сульфитов и сульфатов.
- •43. Общая характеристика элементов vа группы. Свойства простых веществ. Выбор стандартного состояния фосфора. Водородные соединения элементов vа группы, сравнение их электронодонорных свойств.
- •44. Азот, аммиак
- •Билет 45. Оксиды азота
- •Билет 46. Азотная и азотистая кислота, нитраты и нитриты.Окислительно-восстановительныесв-ва нитритов и нитратов. Применение нитратов.
- •47. Кислородсодержащие кислоты фосфора. Полифосфорные кислоты, атф. Растворимость солей ортофосфорной кислоты и их гидролиз.
- •48. Углерод. Полиморфные модификации. Карбиды металлов. Оксиды углерода. Угольная кислота и ее соли. Роль карбонатов в углекислотном балансе атмосферы. “Парниковый” эффект.
- •49. Кремний. Силициды металлов. Силаны. Кремниевые кислоты и силикаты. Стекло.
- •52. Бор. Бороводороды, трехцентровые связи. Боразотные аналоги углеводородов. Борная кислота, пероксобораты.
- •57. Металлы iiв группы. Свойства простых веществ. Степени окисления, свойства гидроксидов, сульфидов. Биологическая роль соединений элементов iiв группы.
- •59. Кислоты и соли, образуемые элементами viв группы в высших степенях окисления. Сравнение кислотных и окислительных свойств.
- •Билет 60. Про марганец
- •Билет №62 Чугуний.
44. Азот, аммиак
Азот относится к элементам 15ой группы (в короткопериодном варианте – к VA подгруппа) Периодической системы вместе с фосфором P, мышьяком As, сурьмой Sb и висмутом Bi.
Атомы имеют два электрона на s-орбитали и три электрона на р-орбиталях внешнего энергетического уровня. Поэтому для них характерны степени окисления +3 и +5. Для азота характерны +1, +2 и +4. В соединениях с менее ЭО элементами будет степень окисления -3.
Примером такого соединения является NH3. Это наиболее важное соединение азота с водородом.
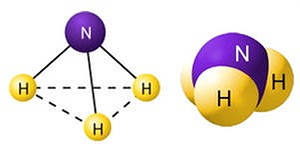 Это
бесцветный ядовитый газ с резким запахом.
У него есть неподеленная электронная
пара, которая определяет геометрическое
строение молекулы – тригональная
пирамида с углом H-N-H
107, 3 (близок к тетраэдрического 109,5).
Это
бесцветный ядовитый газ с резким запахом.
У него есть неподеленная электронная
пара, которая определяет геометрическое
строение молекулы – тригональная
пирамида с углом H-N-H
107, 3 (близок к тетраэдрического 109,5).
Молекула полярная, ее дипольный момент 1,46 Д.
Между молекулами аммиака образуются водородные связи. Из-за этого характерны высокие температуры плавления (-77,8) и кипения (-33,4) по сравнению с водородными соединениями других элементов группы. Из-за этого же аммиак легко сжижается при комнатной температуре под действием сравнительно небольшого давления (примерно 8,5 атм) и при испарении поглощает много теплоты.
Жидкий аммиак – неводный растворитель. Реакция протолиза практически не протекает (константа равновесия очень мала).
Получение: 3H2 + N2 ↔ 2NH3. По принципу Ле Шателье смещение равновесия в сторону продукта достигается при понижении температуры и повышении давления. Но при низких температурах скорость мала, поэтому используют катализатор, который позволяет проводить реакцию при 400-5000 С. Катализатор – железо.
Аммиак хорошо растворим в воде, особенно холодной. Из кипящих водных растворов полностью улетучивается. Водные растворы аммиака имеют щелочную реакцию благодаря протолитическому равновесию:
NH3 + H2O ↔ NH4+ + OH-
K = [NH4+][OH-]\[NH3] = 1,8x10-5
При составлении уравнений с участием водного раствора аммиака обычно используют условную формулу гидроксида аммония NH4OH. В действительности этих молекул не существует.
Кислотных свойств растворы аммиака не проявляют. Но жидкий аммиак взаимодействует со щелочными металлами как очень слабая кислота, образуя амиды:
2Na + 2NH3(ж) = 2NaNH2 + H2↑
Проявляет восстановительные свойства и почти всегда окисляется до N2:
2NH3 + 3Cl2 = N2↑ + 6HCl
2NH3 + 3CuO = N2↑ + 3H2O + 3Cu
4NH3 + 3O2 = 2N2↑ + 6H2O
Кислород в присутствии платинового катализатора окисляет аммиак до NO:
4NH3 + 5O2 = 4NO + 6H2O
Процесс используют в промышленности для производства азотной кислоты.
При взаимодействии с кислотами образуются соли аммония:
NH3 + HNO3 = NH4NO3
NH3 + CH3COOH = NH4CH3COO
Соли аммония хорошо растворимы. В растворах солей аммония происходит гидролиз иона NH4+ (из-за слабости основных свойств аммиака):
NH4+ + H2O ↔ NH3+ H3O+
При нагревании соли аммония разлагаются. Если в составе соли есть атом, который может понизить свою степень окисления, то будет внутримолекулярное ОВ и восстановление до N2:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Если нет такого элемента, то будет выделяться аммиак:
NH4Г = NH3↑+ HГ↑ (Г = F, Cl, Br, I)
(NH4)2CO3 = NH3↑ + H2O + CO2↑
Гидразин.
При обычных условиях дымящаяся бесцветная жидкость с запахом, похожим на запах аммиака.
Получение: 2NH3 + NaOCl = N2H4 + NaCl + H2O. Энергия Гиббса образования положительна, однако гидразин кинетически устойчив. Реакция разложения на простые вещества имеет большую энергию активации, значит, происходит очень медленно.
Горит на воздухе с образованием азота: N2H4 + O2 = N2↑+ 2H2O
Имеет щелочную реакцию раствора (как основание слабее аммиака):
N2H4(р) + H2O ↔ N2H5+ + OH- K = 8,7x10-7
Отщепляет протон от молекулы воды и образует ион гидразония.
Гидразин и соли гидразония более сильные восстановители, чем аммиак. Они даже слабыми кислотами окисляются до азота:
N2H4 + 4Cu(OH)2 = 2Cu2O↓ + N2↑+ 6H2O
