
- •34. Водород. Атом и молекула водорода, изотопы водорода. Гидриды металлов и неметаллов. Водород как окислитель и восстановитель. Получение водорода в лаборатории и в промышленности.
- •36. Вода. Фазовая диаграмма воды. Физические и химические свойства. Автопротолиз. Горение водорода в кислороде. Топливные элементы.
- •37. Пероксид водорода. Окислительно-восстановительные свойства, получение и применение пероксида водорода. Пероксиды металлов.
- •39. Галогеноводороды. Физические и химические свойства (температуры кипения, сила кислот и восстановительная способность). Особенности фтороводорода. Биологическая роль галогенов.
- •40.Кислородные кислоты галогенов. Кислотно-основные и окислительные свойства оксокислот хлора. Устойчивость кислородных кислот хлора и их солей, применение солей оксокислот хлора.
- •41. Сера. Строение молекул и свойства простого вещества. Сероводород и сульфиды. Полисульфиды. Восстановительные свойства сероводорода и сульфидов, растворимость сульфидов металлов.
- •42. Оксиды серы. Получение и свойства оксидов серы (IV) и (VI). Сернистая и серная кислота, сульфиты и сульфаты. Окислительно-восстановительные свойства сульфитов и сульфатов.
- •43. Общая характеристика элементов vа группы. Свойства простых веществ. Выбор стандартного состояния фосфора. Водородные соединения элементов vа группы, сравнение их электронодонорных свойств.
- •44. Азот, аммиак
- •Билет 45. Оксиды азота
- •Билет 46. Азотная и азотистая кислота, нитраты и нитриты.Окислительно-восстановительныесв-ва нитритов и нитратов. Применение нитратов.
- •47. Кислородсодержащие кислоты фосфора. Полифосфорные кислоты, атф. Растворимость солей ортофосфорной кислоты и их гидролиз.
- •48. Углерод. Полиморфные модификации. Карбиды металлов. Оксиды углерода. Угольная кислота и ее соли. Роль карбонатов в углекислотном балансе атмосферы. “Парниковый” эффект.
- •49. Кремний. Силициды металлов. Силаны. Кремниевые кислоты и силикаты. Стекло.
- •52. Бор. Бороводороды, трехцентровые связи. Боразотные аналоги углеводородов. Борная кислота, пероксобораты.
- •57. Металлы iiв группы. Свойства простых веществ. Степени окисления, свойства гидроксидов, сульфидов. Биологическая роль соединений элементов iiв группы.
- •59. Кислоты и соли, образуемые элементами viв группы в высших степенях окисления. Сравнение кислотных и окислительных свойств.
- •Билет 60. Про марганец
- •Билет №62 Чугуний.
43. Общая характеристика элементов vа группы. Свойства простых веществ. Выбор стандартного состояния фосфора. Водородные соединения элементов vа группы, сравнение их электронодонорных свойств.
Общая характеристика элементов VА группы
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi. Общая электронная формула элементов подгруппы азота: ns2np3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не спаренных электрона на р-подуровне. Это р-элементы. Азот, фосфор, мышьяк – типичные неметаллы, сурьма занимает промежуточное положение и висмут – типичный металл.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3.
Радиусы атомов возрастают, а электроотрицательность и энергия ионизации уменьшается при движении сверху вниз (как и должно быть по периодическому закону).
Азот и фосфор – элементы средней распространенности. Большая часть азота находится в атмосфере (78%) в виде N2. Основные минералы – нитраты (селитры) KNO3, NaNO3.
Фосфор присутствует в коре в виде фосфатов. Промышленное значение имеют апатиты – 3Ca(PO4)2*CaX2 (X – F, Cl, OH).
Мышьяк, сурьма и висмут – малораспространенные элементы. Встречаются в природе в виде сульфидов и смешанных сульфидов – As2S3, FeAsS, Sb2S3, Bi2S3.
Свойства простых веществ
Азот — бесцветный газ, не имеющий запаха, малорастворимый в воде.
Также может быть и в жидком состоянии, при температуре кипения — 195,8 °C — бесцветная жидкость. При комнатной температуре и нормальном давлении химически очень инертен, имеет кратность связи 3.
При комнатной температуре реагирует только с литием.
6Li + N2 -> 2Li3N
Фосфор — неметалл, в чистом виде имеет 4 аллотропные модификации. Они все возгоняются, образуя молекулы P4.
Белый фосфор — самая химически активная модификация фосфора. Имеет молекулярное строение; формула P4, форма молекулы — тетраэдр. Чрезвычайно химичеки активен и ядовит. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре. При хранении переходит в более устойчивый красный. Принят за стандартное состояние фосфора.
Красный фосфор — представляет собой полимер со сложной структурой. Имеет формулу Pn. Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С, но самовоспламеняется при трении или ударе. Нерастворим в воде, а также в бензоле, сероуглероде, растворим в трибромиде фосфора. Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре.
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Имеет атомную структуру. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Он проводит электрический ток и имеет свойства полупроводника.
Металлический фосфор. Получается из черного при огромном давлении. Металлический фосфор очень хорошо проводит электрический ток.
Мышьяк, сурьма и висмут. Тоже существуют в виде нескольких аллотропных модификаций, из которых самые устойчивые вида Э4. Получают их обжигом сульфидов и последующим восстановлением углем. При обычных условиях не окисляются кислородом, но при нагревании получаются оксиды вида Э2O3 и Э2O5. Висмут образует только первый.
Водородные соединения элементов VА группы, сравнение их электронодонорных свойств.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН3 – стибин; BiН3 – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Водородные соединения азота. Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды. Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода – аммиак NH3 и гидразин N2H4.
Аммиак
NH3.
Аммиак – один из наиболее важных
промышленных продуктов современной
экономики. В конце 20 в. США производили
ок. 13 млн. т. аммиака ежегодно (в пересчете
на безводный аммиак).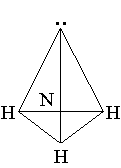
Строение молекулы. Молекула NH3 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
В промышленности получают напрямую из азота и водорода (синтез габера).
Выход реакции мал, но из-за цикличности процесса суммарный выход довольно большой.
N2 + 3H3 -> 2NH3
Водородные соединения фосфора. Наиболее устойчивое – фосфин PH3. Кроме него есть гидриды P2H4, P3H5.
Фосфин PH3. Представляет из себя бесцветный газ. Намного более ядовит, чем аммиак. Но намного более сильный восстановитель, чем аммиак. Получают диспропорционированием красного фосфора в сильнощелочной среде или гидролизом фосфитов.
4P + 3KOH + 3H2O -> PH3 + 3KH2PO2
Ca3P2 + 6H2O -> Ca(OH)2 + 2PH3
Его молекула тоже имеет пирамидальное строение, как и у аммиака, но полярность связи намного меньше, из-за чего он даже не может образовывать водородные связи => плохо растворяется в воде. Проявляет свойства слабого основания в реакциях с самыми сильными кислотами.
PH3 + HI -> PH4I
Водородные соединения остальных.
AsH3, SbH3, BiH3
Висмутин мало изучен, потому что очень неустойчив. Остальные разлагаются при слабом нагревании (арсин) и уже при комнатной температуре (стибин). У всех, кроме аммиака нет водородных связей, что объясняет изменение температур кипения и плавления соединений (выглядят одинаково, только кипения приподнят вверх).
Электродонорные свойства хорошо выражены у аммиака, слабо у фосфина (протонирование идет в незначительно степени) и почти совсем не проявляется у остальных. Хотя есть реакции вида
AsH3 + HГ <-> AsH4Г (Г – Br, I)
Но равновесие в них сильно сдвинуто в сторону образования исходных веществ.
А у стибина основных свойств не обнаружено.
